Координационные соединения металлов представляют собой особый класс химических соединений, в которых центральным атомом является металл. Одноядренные структуры с центральным атомом, характерные для этих соединений, обладают особыми свойствами и широко применяются в различных областях науки и промышленности. В данной статье рассмотрим основные особенности координационных соединений металлов и их роль в химических реакциях.
Координационные соединения металлов образуются благодаря образованию координационных связей между металлическими и лигандными атомами. Лиганды могут быть различными химическими соединениями, такими как водород, оксиды, галогены и органические молекулы. Координационные соединения обладают высокой степенью структурной организации и способностью образовывать сложные архитектурные структуры.
Одноядренные структуры с центральным атомом в координационных соединениях металлов могут иметь различные геометрические формы. Например, молекулы могут быть линейными, плоскими или октаэдрическими. Это свойство определяет их химические и физические свойства. Одноядренные структуры с центральным атомом также могут образовывать комплексы с другими веществами, такими как растворители или катализаторы, что расширяет их применение в химической промышленности и лабораторных исследованиях.
Координационные соединения металлов:

Координационные соединения металлов представляют собой структуры, в которых центральный металлический атом или ион соединяется с другими атомами или ионами через координационные связи. Такие соединения обладают уникальными свойствами, которые определяются структурой координационной сферы металла и его способностью образовывать комплексы с различными лигандами.
Координационные соединения металлов имеют широкое применение в различных областях, включая катализ, аналитическую химию, медицину и материаловедение. Они играют важную роль в разработке новых катализаторов, лекарственных препаратов и функциональных материалов. Благодаря своим уникальным свойствам, координационные соединения металлов могут быть использованы для создания материалов с определенными магнитными, оптическими или электрическими свойствами.
Центральный атом или ион в координационных соединениях металлов обладает определенной координационной сферой, которая определяется числом и типом лигандов, связанных с металлом. Лиганды могут быть одноатомными ионами, такими как галогениды или водородные ионы, или комплексными молекулами, такими как аммиак или этилендиамин. Координация лиганда с металлом осуществляется через образование дативной связи, в которой электронный пар лиганда переходит на металлический атом или ион.
Одноядренные структуры
Одноядренные структуры являются важным классом координационных соединений металлов, где центральным атомом выступает одно ядро. Такие структуры могут образовываться между металлами и различными лигандами, такими как атомы, ионы или молекулы. Они обладают разнообразными свойствами и могут использоваться в различных областях науки и технологии.
Одноядренные структуры могут иметь различную геометрию, которая определяется взаимодействием металла с лигандами. Например, квадратно-плоские структуры формируются, когда четыре лиганда образуют плоскость вокруг центрального атома металла. В случае, когда лиганды располагаются вокруг металла на вершинах тетраэдра, образуется тетраэдрическая структура. Также встречаются структуры с октаэдрической, пирамидальной и другой геометрией.
Одной из особенностей одноядренных структур является их способность к образованию комплексов. Здесь металл может взаимодействовать не только с одним лигандом, но и с несколькими одновременно. Такие комплексы могут иметь разнообразные свойства и часто обладают более высокой химической активностью по сравнению с исходными металлами и лигандами.
Одноядренные структуры находят применение в различных областях, включая координационную химию, катализ, электрохимию и материаловедение. Они используются для создания новых материалов с заданными свойствами, разработки катализаторов для реакций превращения веществ, а также в электрохимических процессах, включая электролиз и аккумуляцию энергии.
Центральный атом

Центральный атом в координационных соединениях металлов играет важную роль, образуя структуру комплекса и определяя его свойства. Центральный атом является металлическим ионом, который способен образовывать координационные связи с лигандами.
Центральный атом может иметь различное электронное строение, что влияет на его способность координации и свойства комплекса. Например, наиболее распространенными центральными атомами являются ионы переходных металлов, такие как железо, медь, никель и др. У них валентные электроны распределены по нескольким энергетическим уровням и могут участвовать в образовании координационных связей с лигандами.
Центральный атом обладает координационным числом, которое определяет, сколько лигандов может присоединиться к нему. Число лигандов, окружающих центральный атом, может быть разным в зависимости от его электронной конфигурации и степени окисления. Таким образом, центральный атом может образовывать комплексы различных структур и свойств.
Одной из основных характеристик центрального атома является его размер. Размер центрального атома влияет на различные факторы, включая электронную конфигурацию и положение лигандов относительно него. Таким образом, размер центрального атома может влиять на координационное число, форму комплекса и его свойства.
Металлические координационные соединения

Металлические координационные соединения являются особым классом соединений, где центральным атомом является металл и он образует связь с одним или несколькими лигандами, т.е. молекулами или ионами, содержащими свободные электроны. В результате образуется координационное соединение, в котором металл играет роль акцептора электронов, а лиганды - роли доноров электронов.
Металлические координационные соединения широко применяются в различных областях: от химической промышленности до медицины. Они имеют высокую химическую и термическую стабильность, что позволяет использовать их в качестве катализаторов, лекарственных препаратов, материалов для электроники и других целей.
Одноядренные структуры с центральным атомом представляют собой комплексы, в которых металл одной связью связан с лигандом. Лиганд может быть органическим или неорганическим ионом, молекулой или атомом. Одноядренные структуры с центральным атомом характеризуются различными свойствами в зависимости от природы металла и лиганда.
Физические свойства металлов в структурах
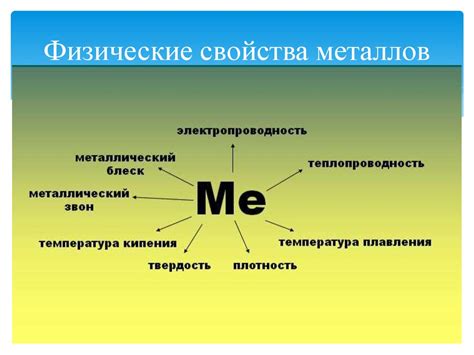
Металлы в структурах обладают рядом физических свойств, которые определяют их поведение и способности в различных средах. Одно из основных свойств металлов - электропроводность. Благодаря наличию свободных электронов внутри кристаллической решетки, металлы могут передавать электрический заряд и являются отличными проводниками электрического тока.
Еще одним важным свойством металлов является теплопроводность. Благодаря свободным электронам, которые могут передвигаться внутри материала, металлы могут быстро и эффективно передавать тепловую энергию. Это обуславливает возможность использования металлов в различных термических процессах и конструкциях, где необходимо обеспечить эффективное распределение тепла.
Сопротивление металлов к механическим нагрузкам также является важным физическим свойством. Металлические структуры характеризуются высокой прочностью и пластичностью, что позволяет им выдерживать большие нагрузки и деформации без разрушения. Это обуславливает широкое применение металлов в машиностроении, строительстве и других отраслях промышленности.
Еще одной характеристикой металлов является их плотность. Металлы обладают достаточно высокой плотностью, что связано с их кристаллической структурой и компактным упаковкой атомов. Благодаря высокой плотности, металлы отличаются от других материалов большой массой и способностью образовывать стройные и прочные структуры.
В целом, физические свойства металлов в структурах обуславливают их особенности и возможности для использования в различных областях промышленности и науки. Наличие электропроводности, теплопроводности, прочности и высокой плотности делают металлы незаменимыми материалами для создания различных конструкций, устройств и материалов.
Вопрос-ответ

Каково строение координационных соединений металлов?
Строение координационных соединений металлов может быть различным, но самыми распространенными являются одноядренные структуры с центральным атомом. В таких структурах металлический ион образует комплекс с лигандами, которые образуют химические связи с металлом через свои электроны.
Какие металлы могут образовывать координационные соединения?
Почти все металлы способны образовывать координационные соединения. Однако наиболее распространены соединения металлов, таких как железо, медь, никель, кобальт, цинк, серебро, золото и платина.
Какие свойства имеют координационные соединения металлов?
Координационные соединения металлов обладают рядом характеристик, включая высокую степень стабильности, способность к образованию комплексов с различными лигандами, изменение структуры и свойств в зависимости от замещения лигандов, а также возможность образования полимерных структур.
В чем заключается роль лигандов в координационных соединениях металлов?
Лиганды играют важную роль в координационных соединениях металлов. Они образуют химические связи с металлом через свои электроны, что позволяет образованию комплексов. Лиганды могут быть атомами, ионами или молекулами, и их выбор влияет на особенности структуры и свойства соединения.
Какие могут быть разновидности одноядренных структур координационных соединений металлов?
Одноядренные структуры координационных соединений металлов могут быть различными. Некоторые примеры включают октаэдрическую структуру, квадратно-плоскую структуру, тетраэдрическую структуру и тригонально-пирамидальную структуру. Конкретная структура зависит от типа металла и лигандов, а также от их расположения в пространстве.
