Химические свойства металлов являются одними из ключевых аспектов изучения химии. Контрольная работа по этой теме представляет собой возможность проявить знания о реакциях между металлами и другими веществами, а также умение анализировать эти реакции.
В процессе контрольной работы ученикам предлагается решить задачи, в которых требуется написать уравнения реакций между металлом и кислотой, металлом и солями, металлом и водой, и т.д. Кроме того, ученикам необходимо проанализировать полученные уравнения и сделать выводы о химических свойствах металлов.
Контрольная работа по химическим свойствам металлов требует от учеников не только знания основных химических реакций, но и умение применять эти знания на практике. Она помогает ученикам развить свои навыки решения химических задач и улучшить свою понимание химических процессов.
Химические свойства металлов: как составить уравнение реакции

Уравнение реакции – это способ записи химической реакции с помощью химических формул и символов. Важной частью такого уравнения являются реагенты и продукты, которые включают в себя химические элементы и соединения.
Когда составляется уравнение реакции для металлов, необходимо учитывать их химические свойства. Металлы обладают свойством активности, которое определяет их способность взаимодействовать с другими веществами.
Для составления уравнения реакции с металлами, нужно ознакомиться с таблицей активности металлов. Эта таблица позволяет определить реакционную способность металла в зависимости от его положения в ряду активности. Чем выше металл в ряду активности, тем он более реакционноспособный.
При составлении уравнения реакции с участием металлов, необходимо учесть такие факторы как тип реагента (кислота, оксид, соль и т.д.), условия реакции (температура, концентрация и др.) и физические свойства металла (мольная масса, валентность и т.д.).
Уравнение реакции с металлом должно быть сбалансировано, то есть число атомов каждого элемента в реагентах должно быть равно числу атомов этого элемента в продуктах. Для этого можно использовать коэффициенты перед формулами веществ.
Контрольная работа по химическим свойствам металлов: основная информация

В химии металлы играют важную роль, так как они обладают уникальными химическими свойствами. В контрольной работе по химическим свойствам металлов мы будем изучать и анализировать уравнения реакций, связанных с реакцией металлов с кислотами, водой и кислотными оксидами.
Одной из основных реакций, которую мы изучим, является реакция металлов с кислотами. При этой реакции металл образует соль и выделяется водород. Уравнение реакции можно записать в виде: металл + кислота → соль + водород. Важно помнить, что различные металлы имеют различную реакционную способность, и поэтому скорость и интенсивность реакции будут различаться.
Кроме того, мы будем изучать реакцию металлов с водой. Некоторые металлы, такие как натрий и калий, активно взаимодействуют с водой, образуя гидроксиды и выделяяся водород. Другие же металлы, такие как железо и алюминий, для реакции с водой требуют наличия катализатора или повышенной температуры. Уравнения реакций металлов с водой можно записать в виде: металл + вода → гидроксид + водород.
Также важно изучать реакцию металлов с кислотными оксидами. Некоторые металлы могут образовывать с ними соли и выделяться водород. Уравнение реакции можно записать в виде: металл + кислотный оксид → соль + водород.
Все эти реакции могут быть представлены в виде уравнений, которые являются основой для анализа химических свойств металлов. В контрольной работе мы будем исследовать эти уравнения и анализировать результаты реакций, чтобы лучше понять химические свойства металлов и их взаимодействие с другими веществами.
Уравнение реакции: типы реакций металлов с кислотами и водой

Металлы проявляют различные химические свойства при взаимодействии с кислотами и водой. Эти реакции можно подразделить на несколько типов.
Реакция металла с кислотой:
- Реакция активных металлов с кислородистыми кислотами, такими как серная или азотная, происходит с образованием соли и выделением водорода. Например, при реакции цинка с серной кислотой образуется сульфат цинка и выделяется водородный газ:
- Zn + H2SO4 → ZnSO4 + H2
- Менее активные металлы, такие как железо или алюминий, реагируют только с концентрированными кислотами, образуя соли и выделяя водород. Например, при взаимодействии железа с соляной кислотой образуется хлорид железа и выделяется водородный газ:
- Fe + 2HCl → FeCl2 + H2
- Некоторые металлы, такие как медь или серебро, не реагируют с обычными кислотами, но могут реагировать с кислородной кислотой в присутствии катализатора. Например, при взаимодействии меди с азотной кислотой в присутствии медного порошка образуется нитрат меди и выделяется водород:
- Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO
Реакция металла с водой:
Взаимодействие металлов с водой может протекать по-разному, в зависимости от активности металла.
- Активные металлы, такие как натрий или калий, реагируют с водой с выделением водорода и образованием гидроксида металла:
- 2Na + 2H2O → 2NaOH + H2
- Некоторые металлы, например, магний или алюминий, реагируют с водой только при нагревании и образуют соответствующие гидроксиды и водород:
- 2Mg + 2H2O → 2Mg(OH)2 + H2
- Некоторые металлы, например, железо или цинк, не реагируют с холодной водой, но реагируют с паром воды при повышенной температуре, образуя соответствующие гидроксиды и водород:
- Zn + H2O(g) → Zn(OH)2 + H2
Знание уравнений данных реакций позволяет более полно представить процесс взаимодействия металлов с кислотами и водой.
Методы анализа уравнений реакций металлов: балансировка

Балансировка уравнений реакций металлов является важным методом анализа химических свойств металлов. Она позволяет выстраивать соответствие между количеством атомов каждого элемента в реакции, что отражает закон сохранения массы. Балансировка проводится путем изменения коэффициентов перед формулами веществ, участвующих в реакции.
Для начала балансировки уравнений реакций металлов необходимо определить, какие вещества и элементы присутствуют в реакции. Затем нужно определить количество атомов каждого элемента в начальных и конечных веществах. После этого, используя коэффициенты перед формулами, рассчитывается количество атомов каждого элемента в реакции.
Перед балансировкой уравнения реакции металлов важно установить, какие элементы находятся в реагирующих веществах и продуктах. Если вещества содержат комплексные ионы, необходимо обратить внимание на их состав. При балансировке уравнений также следует учитывать различные оксидационные состояния металлов и правила для их определения.
Важно отметить, что балансировка уравнений реакций металлов может быть сложной задачей, особенно когда в реакции участвуют несколько металлов или когда вещества имеют различные оксидационные состояния. Поэтому для успешной балансировки уравнений необходимо хорошее знание химических свойств металлов и умение применять соответствующие правила и методы анализа.
Окислительно-восстановительные реакции металлов

Окислительно-восстановительные реакции металлов представляют собой химические процессы, в которых происходит перенос электронов между атомами и ионами металлов. В этих реакциях металлы могут выступать и в роли окислителей и в роли восстановителей.
Металлы, обладающие относительно низкой электроотрицательностью, способны отдавать электроны и вести себя как восстановители в окислительно-восстановительных реакциях. Например, натрий (Na) при реакции с кислородом (O) образует оксид натрия (Na2O) и теряет электроны, ведя себя как восстановитель.
С другой стороны, металлы с более высокой электроотрицательностью могут принимать электроны от других веществ и вести себя как окислители. Например, железо (Fe) при реакции с кислородом образует оксид железа (Fe2O3) и принимает электроны, ведя себя как окислитель.
В окислительно-восстановительных реакциях металлов участвуют также водородные и галогенные соединения. Например, при реакции железа с хлором образуется хлорид железа (FeCl3) и происходит перенос электронов, где железо окисляется и ведет себя как окислитель, а хлор восстанавливается и ведет себя как восстановитель.
Окислительно-восстановительные реакции металлов находят широкое применение в различных областях, включая промышленность, энергетику и науку. Изучение и анализ таких реакций позволяют углубить знания о свойствах металлов и использовать их в практических целях.
Химические свойства металлов: реакции с кислородом и неокисленные состояния
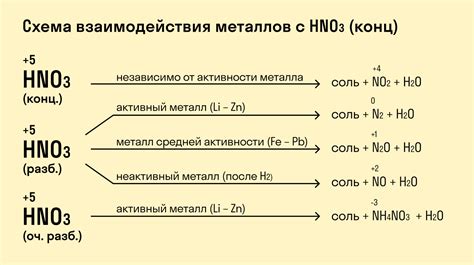
Металлы обладают уникальными химическими свойствами, включая их реакции с кислородом. Когда металлы взаимодействуют с кислородом, они могут образовывать соединения, которые могут быть как окислами, так и неокисленными.
Реакции металлов с кислородом приводят к образованию оксидов. Некоторые металлы могут образовывать различные оксиды, в зависимости от степени окисления. Например, железо может образовывать оксиды FeO, Fe2O3 и Fe3O4. Оксиды металлов могут иметь разные свойства и использоваться в различных отраслях промышленности.
Однако, не все реакции металлов с кислородом приводят к образованию оксидов. Некоторые металлы, такие как алюминий и титан, могут образовывать неокисленные соединения с кислородом. Например, алюминий может образовывать соединение Al2O3, которое называется гидроксидом алюминия.
Неокисленные состояния металлов с кислородом могут иметь важное значение в различных областях науки и техники. Например, соединения алюминия с кислородом используются в производстве алюминиевых сплавов и в производстве керамики. Эти соединения обладают высокой прочностью и стойкостью к различным факторам окружающей среды.
Таким образом, реакции металлов с кислородом являются важным аспектом изучения химических свойств металлов. Они позволяют получать различные соединения, которые имеют широкий спектр применения и могут быть использованы в различных отраслях промышленности и научных исследований.
Анализ химических свойств металлов: способы определения активности металлов

Химические свойства металлов играют важную роль в различных процессах и реакциях. Одним из важных параметров химической активности металлов является их способность вступать в реакции с другими веществами. Для определения активности металлов используются различные методы и эксперименты.
Один из наиболее распространенных способов определения активности металлов - это реакция металла с кислотами. Кислоты обладают сильными окислительными свойствами и способны реагировать с металлами, образуя соли. При этом активные металлы, такие как натрий, реагируют с кислотами более интенсивно, протекает более энергичная реакция и выделяется больше тепла.
Другой способ определения активности металлов - это их реакция с водой. Некоторые металлы, такие как калий и натрий, реагируют с водой весьма активно, при этом выделяется водородный газ. Однако, есть и металлы, которые практически не реагируют с водой, например, золото или серебро. При такой реакции можно определить степень активности металла и его способность совершать окислительно-восстановительные реакции.
Также существуют способы определения активности металлов по их возможности вытеснить другой металл из раствора или соли. Если металл является более активным, то он будет вытеснять менее активный металл из его соли. Например, цинк может вытеснить медь из ее сульфата, так как цинк активнее меди.
Таким образом, анализ химических свойств металлов и определение их активности является важным шагом для понимания их поведения в различных химических реакциях и процессах. Работа с металлами имеет большую практическую значимость и используется во многих отраслях науки и промышленности.
Вопрос-ответ

Какие уравнения реакций можно использовать в контрольной работе по химическим свойствам металлов?
В контрольной работе по химическим свойствам металлов можно использовать уравнения реакций, описывающие реакции металлов с кислородом, водой, кислотами и основаниями.
Какой анализ необходимо проводить уравнений реакций в контрольной работе?
При анализе уравнений реакций в контрольной работе необходимо определить типы реакций (окислительно-восстановительные, кислотно-основные и т.д.), баланс массы и заряда перед реакцией и после нее, а также произвести расчеты, основанные на данной информации.
Какие химические свойства металлов могут быть рассмотрены в контрольной работе по химии?
В контрольной работе по химии могут быть рассмотрены различные химические свойства металлов, такие как способность образовывать ионы, способность реагировать с другими химическими веществами, типы реакций, в которых участвуют металлы, а также их способность проявлять свойства окислителей или восстановителей.
