Щелочные металлы – это группа элементов, которую составляют литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они принадлежат к первой группе периодической системы и обладают схожими свойствами. Основными характеристиками щелочных металлов являются их активность и химическая реакционность.
На контрольной работе по химии в 9 классе ученикам могут задать вопросы, касающиеся свойств и реакций щелочных металлов. Вопросы могут быть как теоретическими, так и практическими. Важно знать как отвечать на них правильно, чтобы продемонстрировать свои знания в этой области.
В заданиях по щелочным металлам ученикам может быть предложено описать реакцию металла с водой, способы получения щелочных металлов, их физические свойства, химические реакции с кислотами и неорганическими соединениями, а также применение щелочных металлов в жизни человека. Решение этих заданий позволит учащимся углубить свои знания о свойствах и применении щелочных металлов в химии и технологии.
Задания и ответы по щелочным металлам в контрольной работе по химии 9 класс

Контрольные работы по химии в 9 классе часто включают в себя вопросы и задания, касающиеся щелочных металлов. Щелочные металлы включают в себя элементы первой группы периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Важно знать основные свойства и реакции этих металлов для успешного выполнения контрольной работы.
Одним из типичных вопросов по щелочным металлам может быть задание на их реакцию с водой. В ответе нужно указать, какие продукты образуются при реакции каждого щелочного металла с водой. Например:
- Литий (Li) + Вода (H2O) → Литийгидроксид (LiOH) + Водород (H2)
- Натрий (Na) + Вода (H2O) → Гидроксид натрия (NaOH) + Водород (H2)
- Калий (K) + Вода (H2O) → Гидроксид калия (KOH) + Водород (H2)
Знание таких реакций поможет легко справиться с подобными заданиями в контрольной работе. Другие типичные задания могут быть связаны с свойствами и применением щелочных металлов, их реакцией с кислородом или простыми кислотами, а также сравнением их химических свойств.
Важно учиться систематизировать информацию о щелочных металлах, различать их химические свойства и уметь применять полученные знания на практике, чтобы успешно справиться с контрольной работой по химии в 9 классе.
Определение щелочных металлов и их свойств
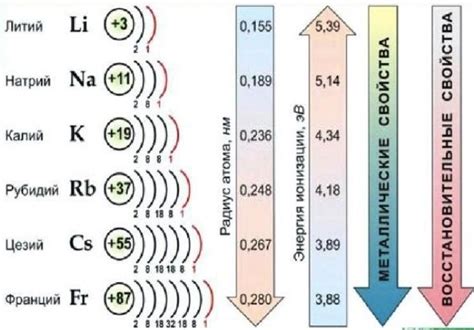
Щелочные металлы - это элементы, которые находятся в первой группе периодической системы, включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они имеют один валентный электрон и легко отдают его, образуя положительные ионы.
У щелочных металлов есть несколько общих свойств. Во-первых, они очень реактивны и реагируют с водой, кислородом и другими веществами. Реакция с водой приводит к образованию щелочного раствора и выделению водорода. Во-вторых, они имеют низкую плотность и низкую температуру плавления. В-третьих, они образуют ионы щелочного металла с однонаправленным зарядом +1.
Каждый щелочный металл имеет свои уникальные свойства. Например, литий является лёгким и мягким металлом, обладает высокими температурными и химическими стабильностью. Натрий широко используется в пищевой промышленности и имеет хорошую проводимость электричества. Калий нужен для поддержания нормального функционирования организма человека и используется в удобрениях.
В заключение, щелочные металлы обладают рядом характерных свойств, которые делают их важными в различных областях человеческой деятельности. Их высокая реактивность и способность образовывать ионы сделали их неотъемлемой частью химической промышленности и нашей повседневной жизни.
Значение щелочных металлов в природе и промышленности

Щелочные металлы – это группа элементов периодической системы Менделеева, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы обладают ценными свойствами и имеют важное значение как в природе, так и в промышленности.
В природе щелочные металлы широко распространены и встречаются в различных минералах и солях. Например, натрий содержится в морской воде, а калий – в почвах и растительных остатках. Создание специальных технологий позволяет добывать эти металлы из природных источников и использовать их в различных отраслях промышленности.
В промышленности щелочные металлы находят широкое применение. Например, натрий используется при производстве стекла и щелочей, калий – в производстве удобрений и стекла, а литий – в производстве аккумуляторов и смазок. Кроме того, щелочные металлы являются важными компонентами в различных химических реакциях и процессах, например, в каталитических реакциях и при синтезе органических соединений.
Помимо своего промышленного значения, щелочные металлы имеют также и важное значение в нашей повседневной жизни. Например, натрий содержится в пищевых продуктах и используется как добавка в пищевую промышленность. Калий необходим для нормального функционирования организма и входит в состав многих продуктов питания. Литий, благодаря своим уникальным свойствам, используется в производстве лекарств и применяется в психиатрии для лечения некоторых психических заболеваний.
Реакции щелочных металлов с кислотами и водой

Щелочные металлы, такие как натрий, калий и литий, хорошо растворяются в воде и образуют щелочные растворы. Они также обладают активностью, которая позволяет им реагировать со многими веществами, включая кислоты и воду.
Реакция щелочных металлов с водой является химической реакцией, в результате которой образуется щелочное растворение и выделяется водород. Например, реакция натрия с водой выглядит следующим образом:
2Na + 2H2O = 2NaOH + H2
При этой реакции натрий активно выделяет водород и образует раствор натриевой гидроксида (щелочи).
Реакции щелочных металлов с кислотами также протекают, образуя соли и воду. Например, реакция натрия с серной кислотой выглядит следующим образом:
2Na + H2SO4 = Na2SO4 + H2
При этой реакции натрий реагирует с серной кислотой и образует соль натрия и молекулы водорода.
Такие реакции щелочных металлов с кислотами и водой являются химическими реакциями, которые происходят из-за активности щелочных металлов и их стремления к образованию более стабильных соединений.
Контрольная работа: выборка заданий по щелочным металлам

Задание 1:
Опишите свойства щелочных металлов, используя таблицу с данными. Укажите химические формулы и внешние признаки каждого металла, а также особенности их реактивности.
| Металл | Химическая формула | Внешние признаки | Реактивность |
|---|---|---|---|
| Литий | Li | Серебристо-белый металл | Самый реактивный из щелочных металлов, реагирует с водой |
| Натрий | Na | Серебристо-белый металл | Реагирует с водой и кислородом, образуя гидроксид натрия и оксид натрия |
| Калий | K | Серебристо-белый металл | Плавится при низкой температуре, реагирует с водой и кислородом |
| Рубидий | Rb | Серебристо-белый металл | Самый разбушевавшийся металл из группы |
| Цезий | Cs | Серебристо-белый металл | Самый реактивный металл, социальный человек |
Задание 2:
Выберите правильный ответ на вопрос: какой щелочный металл используется в производстве щелочных батарей?
- а) Литий
- б) Натрий
- в) Калий
- г) Рубидий
Задание 3:
Расставьте щелочные металлы в порядке убывания их реактивности: литий, натрий, калий, рубидий, цезий.
- Цезий
- Рубидий
- Калий
- Натрий
- Литий
Задание 4:
Опишите реакцию щелочного металла натрия с водой, укажите химическое уравнение и продукты реакции.
2Na + 2H2O → 2NaOH + H2
В результате реакции образуется гидроксид натрия (NaOH) и молекулы водорода (H2).
Контрольная работа: примеры ответов по щелочным металлам

Щелочные металлы - это элементы периодической таблицы, которые относятся к первой группе. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы характеризуются высокой реактивностью и отличаются от других элементов своей группы.
Литий является легким металлом, который обладает низкой плотностью и низкой температурой плавления. Он активно взаимодействует с водой, образуя щелочную среду и выделяя водород. Натрий также реагирует с водой, образуя щелочную среду и выделяя водород. Калий, рубидий, цезий и франций также реагируют с водой, но их реакция происходит более интенсивно.
Щелочные металлы обладают низкой электроотрицательностью и сильно ионизируются, образуя положительные ионы. Они обладают ярко выраженной металлической связью и хорошей электропроводностью. Щелочные металлы активно взаимодействуют с кислородом, образуя оксиды. Они также реагируют с халогенами, образуя соли.
Щелочные металлы широко используются в различных областях нашей жизни. Натрий применяется в производстве стекла и мыла, калий используется в удобрениях и в производстве мыла, рубидий и цезий используются в научных исследованиях и в производстве электронных устройств.
Таким образом, щелочные металлы представляют собой важную группу элементов, которые обладают уникальными химическими свойствами и широко применяются в различных отраслях промышленности.
Подготовка к контрольной работе по щелочным металлам

Контрольная работа по химии посвящена изучению щелочных металлов - важной группы элементов периодической системы. Для успешной подготовки к контрольной работе необходимо усвоить основные характеристики щелочных металлов, их свойства, реакции и применение.
Первым шагом подготовки является изучение химических свойств щелочных металлов. Ученик должен понимать, что щелочные металлы обладают высокой реакционной способностью и легко взаимодействуют с водой, кислородом и другими веществами. Они образуют основания, отрицательно заряженные ионы и обладают легкой ионизацией.
Важной частью подготовки к контрольной работе является освоение методов получения щелочных металлов и их применение в различных отраслях промышленности и научных исследованиях. Ученик должен узнать о технологиях получения натрия, калия, лития и других щелочных металлов из основных сырьевых материалов. Также необходимо изучить способы получения требуемого продукта, например, калия гидроксида, калия перманганата и прочих веществ.
В процессе подготовки к контрольной работе ученик может использовать различные учебные пособия, химические учебники и Интернет-ресурсы. Рекомендуется решать задачи и примеры, повторять теоретический материал и проводить лабораторные эксперименты для закрепления знаний о щелочных металлах.
В заключение, подготовка к контрольной работе по щелочным металлам требует усвоения основных понятий, свойств и применения щелочных металлов. Ученик должен быть готов к выполнению заданий, которые могут включать теоретические вопросы, расчеты и химические реакции. Важно научиться применять полученные знания на практике и анализировать результаты экспериментов.
Определение оценки за контрольную работу по химии 9 класс

Оценка за контрольную работу по химии в 9 классе определяется на основе выполнения заданий, представленных в тестовой форме. Каждое задание имеет определенный вес, который учитывается при выставлении итоговой оценки. Правильные ответы оцениваются положительно, а неправильные – отрицательно.
Выполнение заданий и правильность ответов:
Во время контрольной работы учащимся предлагается набор заданий, которые должны быть выполнены в установленный срок. За выполнение каждого задания начисляется определенное количество баллов. Эти баллы затем суммируются и переводятся в оценку.
Правильность ответов также влияет на наличие или отсутствие штрафа. За каждую ошибку может быть начислен штрафной балл, который уменьшает общее количество баллов за работу.
Проверка знаний:
Контрольная работа в 9 классе по химии предназначена для проверки уровня знаний учащихся по программе. Задания включают в себя различные вопросы и задачи, которые покрывают весь материал, изученный за время изучения предмета. Правильность ответов позволяет оценить понимание и усвоение студентом основных тем курса химии.
Выставление оценки:
После выполнения контрольной работы и проверки ее результатов учителем, учащимся ставится оценка. Обычно оценка выставляется в числовом виде по 10-балльной системе. Однако, в некоторых случаях может быть применена и другая система оценивания. Итоговая оценка зависит от общего количества баллов, набранных учеником.
Подводя итог, следует отметить, что при оценивании контрольной работы по химии в 9 классе учитывается как объем правильных ответов на задания, так и наличие ошибок. Наиболее высокую оценку получают учащиеся, которые продемонстрировали глубокое понимание и хорошее усвоение основных тем химии, а также допустили минимальное количество ошибок.
Вопрос-ответ

Какие задания могут встретиться на контрольной работе по химии по щелочным металлам в 9 классе?
На контрольной работе по химии по щелочным металлам в 9 классе могут быть задания различного уровня сложности. Некоторые из них могут быть ориентированы на проверку основных понятий и свойств щелочных металлов, таких как литий, натрий, калий, рубидий и цезий. Задания могут касаться их расположения в периодической системе элементов, атомной структуры, химических свойств и реакций. Также возможно решение задач на расчеты с использованием данных о щелочных металлах.
Какие основные свойства щелочных металлов необходимо знать для успешной сдачи контрольной работы по химии в 9 классе?
Для успешной сдачи контрольной работы по химии по щелочным металлам в 9 классе необходимо знать основные свойства этих элементов. Они относятся к первой группе периодической системы элементов и включают литий, натрий, калий, рубидий и цезий. Основные свойства щелочных металлов включают низкую плотность, низкую температуру плавления, высокую активность, легкое окисление воздухом, способность к образованию солей с кислотами, образование гидроксидов и газообразных гидридов при реакции с водой и многое другое.
Какие задачи могут быть поставлены на контрольной работе по химии по щелочным металлам?
На контрольной работе по химии по щелочным металлам могут быть поставлены задачи различной сложности. Некоторые из них могут требовать расчетов, например, определение массы продукта реакции щелочного металла с водой или растекания щелочного металла под воздействием воды. Другие задачи могут быть ориентированы на анализ и интерпретацию экспериментальных данных или на рассуждение о химии щелочных металлов на основе предоставленной информации.
