Щелочные металлы – это группа элементов периодической системы, которые встречаются в первой группе и обладают рядом общих свойств. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Силой сильные металлы, они являются отличными проводниками электричества и тепла.
Одним из главных свойств щелочных металлов является их насыщение воздухом. Они вступают в реакцию с кислородом и образуют оксиды. В сыром виде они темнеют на воздухе и медленно окисляются. Вода также является реагентом для щелочных металлов. Они реагируют с ней, образуя гидроксиды и высвобождая водород.
Щелочные металлы обладают высокой реактивностью. Они способны реагировать с различными веществами, включая кислоты, галогены и многие другие. Реакция между щелочными металлами и кислотами может протекать с выделением большого количества тепла и газов. Это обуславливает взрывоопасность данного процесса и требует соблюдения осторожности при работе с щелочными металлами.
Что такое щелочные металлы
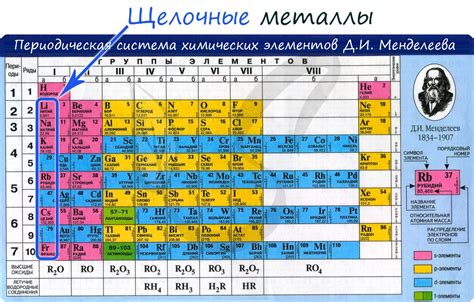
Щелочные металлы - это группа химических элементов, которые находятся в первой группе периодической системы Д.И.Менделеева. Главными представителями щелочных металлов являются литий, натрий, калий, рубидий, цезий и франций.
Основной характеристикой щелочных металлов является то, что они образуют щелочные оксиды, гидроксиды и соли. Это связано с тем, что внешний электронный слой атома щелочных металлов содержит всего один электрон. Благодаря этому, щелочные металлы обладают высокой реактивностью и способностью образовывать ионные связи.
Щелочные металлы обладают такими свойствами, как мягкость, низкая плотность и низкая температура плавления. Они являются хорошими проводниками тепла и электричества. Кроме того, щелочные металлы имеют способность реагировать с водой, образуя щелочные гидроксиды и выделяя водородный газ.
Щелочные металлы широко используются в различных отраслях науки и промышленности. Например, они применяются в производстве щелочных ионных батарей, в производстве стекла, удобрений и других химических соединений. Также щелочные металлы нашли свое применение в медицине, электронике и других сферах человеческой деятельности.
Физические свойства щелочных металлов

Щелочные металлы – это элементы периодической системы, относящиеся к первой группе. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У щелочных металлов есть несколько общих физических свойств, которые делают их уникальными.
Первое характерное свойство щелочных металлов – их низкая плотность. Они являются легкими металлами, и в сравнении с другими элементами периодической системы, имеют малую массу. Это свойство делает их легкими для обработки и перевозки.
Второе характерное свойство щелочных металлов – их низкая температура плавления. Щелочные металлы имеют низкую точку плавления, что позволяет им быстро переходить из твердого состояния в жидкое при нагревании. Например, литий имеет точку плавления всего около 180°C.
Третье характерное свойство щелочных металлов – их мягкость. Они являются наиболее мягкими металлами в периодической системе. Щелочные металлы могут быть настолько мягкими, что могут резаться ножом или даже вырезаться при помощи ногтей.
Четвертое характерное свойство щелочных металлов – их низкая твердость. Из-за своей мягкости, щелочные металлы обладают низкой твердостью. Они легко деформируются и распадаются под воздействием механического давления.
В целом, физические свойства щелочных металлов делают их уникальными и полезными для различных применений. Они широко используются в химической промышленности, электротехнике, медицине и других отраслях науки и техники.
Точка плавления и кипения

Точка плавления и кипения – это физические характеристики вещества, которые определяются его химическим составом и структурой. У щелочных металлов, таких как литий, натрий и калий, очень низкая точка плавления и кипения, что делает их известными как самые низкотемпературные металлы.
Литий имеет точку плавления всего при 180 градусах Цельсия и точку кипения при 1342 градусах Цельсия. Натрий имеет точку плавления при 97.8 градусах Цельсия и точку кипения при 892 градусах Цельсия. Калий имеет точку плавления при 63.4 градусах Цельсия и точку кипения при 759 градусах Цельсия.
Такие низкие температуры плавления и кипения у щелочных металлов объясняются их атомной структурой и химическими связями. Они имеют только одну валентную электронную оболочку, что делает их атомы очень нестабильными и склонными к образованию электронных пар с другими атомами.
Это также делает щелочные металлы очень реактивными и легко окисляемыми. Они реагируют с водой, кислородом и другими веществами, что может вызывать взрывы и пожары при неправильном обращении.
Точка плавления и кипения щелочных металлов играет важную роль в их применении. Их низкая температура плавления позволяет использовать их в различных технологических и промышленных процессах, а также в разработке специальных сплавов.
Плотность
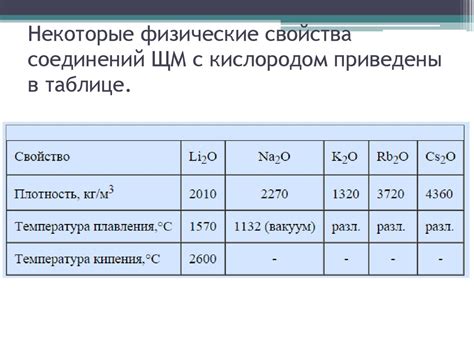
Плотность щелочных металлов весьма высока. Например, плотность лития составляет около 0,53 г/см³, натрия - около 0,97 г/см³, калия - около 0,86 г/см³, рубидия - около 1,53 г/см³, цезия - около 1,87 г/см³. По сравнению с другими металлами плотность щелочных металлов достаточно низкая, что делает их довольно легкими и обеспечивает хороший плавучесть.
Щелочные металлы обладают низкой плотностью благодаря малому атомному радиусу и большой площади поверхности, что приводит к образованию сравнительно большого количества вакансий в кристаллической решетке. Это позволяет межметаллическим ионам легко перемещаться и образовывать металлический проводник электричества сами по себе.
Также следует отметить, что с увеличением атомного номера внутренние электроны всё больше притягиваются к ядру, что приводит к уменьшению размеров атома и увеличению его плотности. Это объясняет постепенное возрастание плотности щелочных металлов при движении по периоду.
Химические свойства щелочных металлов

Щелочные металлы – это элементы периодической системы, которые входят в первую группу: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой реактивностью и обладают рядом характерных химических свойств.
Первое свойство – возможность взаимодействия со водой. При контакте с водой щелочные металлы образуют гидроксиды и выделяются водородный газ. Реактивность металлов в этом процессе возрастает по мере движения вниз по группе, причем франций является самым реактивным металлом этой группы.
Второе свойство – способность образовывать ионы, имеющие положительный заряд. Щелочные металлы легко отдают один электрон, образуя ионы с зарядом +1. Это делает их хорошими сильными электропроводниками и участниками реакций окисления-восстановления.
Третье свойство – способность образовывать сильные основания. Гидроксиды щелочных металлов обладают высокой щелочностью и широко используются в различных отраслях промышленности. Более того, они могут образовывать соли с кислотами, что является основанием для многих реакций.
Четвертое свойство – способность образовывать соединения с многими элементами. Щелочные металлы образуют множество соединений с кислородом, серой, галогенами и другими элементами. Важными соединениями, в которых участвуют щелочные металлы, являются хлориды, бромиды, йодиды и сульфаты.
Таким образом, химические свойства щелочных металлов определяют их роль в химии и технологии, а также их применение в различных областях, начиная от производства лекарств и пищевых добавок, и заканчивая созданием батарей илмазовой электропроводимости.
Взаимодействие с водой

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, являются очень реактивными веществами и реагируют с водой при контакте. При этом происходит образование щелочного гидроксида и выделение водорода. Реакция водорода с кислородом, который содержится в воздухе, приводит к его воспламенению, что делает взаимодействие щелочных металлов с водой достаточно опасным.
В процессе реакции со водой достаточно большое количество энергии выделяется, поэтому это взаимодействие сопровождается эффектом раскаленной поверхности и появлением пламени. Чем больше атомные массы щелочных металлов, тем более интенсивная является реакция. Например, литий, первый элемент в группе щелочных металлов, реагирует спокойно и медленно с водой, в то время как цезий, последний элемент в группе, реагирует очень быстро и взрывоопасно.
При взаимодействии с водой происходит образование щелочного гидроксида. Например, если растворить литий в воде, образуется литиевый гидроксид (LiOH). Гидроксиды щелочных металлов являются сильными щелочными соединениями и широко используются в различных отраслях промышленности и научных исследованиях.
Реакция щелочных металлов с кислородом
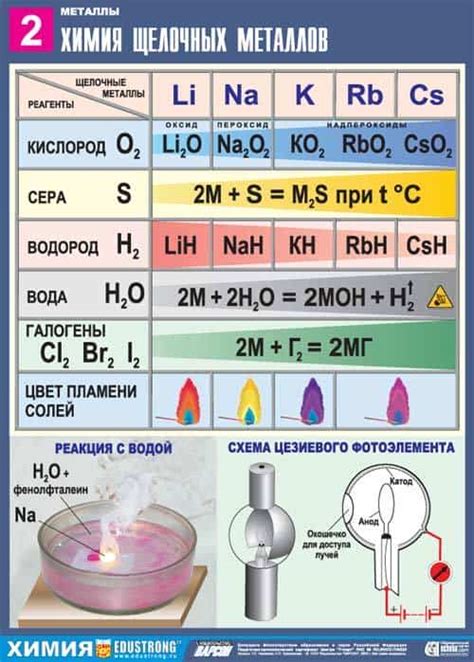
Щелочные металлы, такие как литий, натрий и калий, реагируют с кислородом воздуха, образуя оксиды. Эта реакция осуществляется при нагревании металла до достаточно высокой температуры и представляет собой окислительно-восстановительный процесс.
В результате реакции щелочных металлов с кислородом образуются щелочные оксиды, которые различаются в зависимости от металла. Например, литий образует оксид Li2O, натрий - оксид Na2O, а калий - оксид K2O. Эти оксиды являются белыми кристаллическими веществами, растворимыми в воде и обладающими щелочными свойствами.
В процессе реакции с кислородом щелочные металлы окисляются, а кислород восстанавливается. Это обусловлено высокой активностью щелочных металлов, которые обладают высокой способностью отдавать электроны. Кислород воздуха действует как окислитель, принимая электроны от щелочных металлов и образуя оксиды.
Реакция щелочных металлов с кислородом является экзотермической, то есть при ее проведении выделяется тепло. При контакте металлической поверхности с кислородом происходит быстрое окисление и возгорание, сопровождающееся выделением яркого пламени. Поэтому при работе с щелочными металлами необходимо соблюдать предосторожность и использовать соответствующие средства защиты.
Взаимодействие щелочных металлов с кислотами

Щелочные металлы (литий, натрий, калий, рубидий и цезий) проявляют сильную реакцию с кислотами. В результате взаимодействия образуются соли и выделяются водород.
В самые простые случаи взаимодействия щелочных металлов с кислотами образуются хлориды металлов и выделяется водород. Например:
- 2Li + 2HCl → 2LiCl + H2
- 2Na + 2HCl → 2NaCl + H2
- 2K + 2HCl → 2KCl + H2
Взаимодействие щелочных металлов с более слабыми кислотами, такими как азотная или серная, происходит с образованием нитратов или сульфатов металлов и выделением водорода. Например:
- 2Na + 2HNO3 → 2NaNO3 + H2
- 2K + 2HNO3 → 2KNO3 + H2
- 2Li + H2SO4 → Li2SO4 + H2
Реактивность щелочных металлов с кислотами возрастает по мере увеличения их атомного радиуса в периоде. Литий, имеющий самый маленький атомный радиус, проявляет наименьшую реактивность, а цезий, обладающий наибольшим атомным радиусом, проявляет наибольшую реактивность при взаимодействии с кислотами.
Реактивность щелочных металлов
Щелочные металлы - это элементы первой группы (IA) периодической системы химических элементов. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы обладают высокой реактивностью, что делает их полезными во многих химических и промышленных процессах.
Щелочные металлы являются сильными основаниями и реагируют с водой, образуя щелочные растворы и выделяя водород. Например, натрий реагирует с водой, образуя гидроксид натрия и выделяя водород:
2Na + 2H2O → 2NaOH + H2↑
Они также реагируют с кислородом, горючими веществами и неорганическими соединениями. Например, литий реагирует с кислородом, образуя оксид лития:
4Li + O2 → 2Li2O
Важной особенностью щелочных металлов является их способность образовывать амальгамы с ртутью. Это особенно характерно для натрия и калия, которые могут реагировать с ртутью даже при комнатной температуре.
Реактивность щелочных металлов связана с их низкой энергией ионизации и большой атомной радиусом. Они легко отдают свой внешний электрон и образуют положительные ионы, что позволяет им легко реагировать с другими веществами.
Вопрос-ответ

Какие щелочные металлы существуют?
Щелочными металлами являются литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Каковы основные свойства щелочных металлов?
Щелочные металлы имеют низкую плотность, низкую температуру плавления, низкую температуру кипения, мягкую текстуру и серебристый цвет. Они являются отличными проводниками электричества и тепла. Также они реагируют с водой и выделяют газ водород.
Каковы реакции щелочных металлов с водой?
Щелочные металлы реагируют с водой, образуя оксиды щелочных металлов и выделяя газ водород. Например, натрий реагирует с водой, образуя оксид натрия (Na2O) и выделяя водородный газ (H2).
Каковы основные применения щелочных металлов?
Щелочные металлы имеют широкое применение в различных областях. Например, литий используется в производстве аккумуляторов, натрий - в пищевой промышленности, калий - в сельском хозяйстве, рубидий - в научных исследованиях, а цезий - в ядерной промышленности.
Какова реактивность щелочных металлов?
Щелочные металлы являются очень реактивными и легко реагируют с другими веществами. Например, они реагируют с кислородом из воздуха, образуя оксиды щелочных металлов. Также они реагируют с хлором, образуя хлориды, и с серой, образуя сульфиды.
