Щелочные металлы, такие как литий (Li), натрий (Na) и калий (K), являются важными элементами химии. Они обладают высокой реактивностью и легко соединяются с другими элементами для образования различных соединений. Соединения щелочных металлов широко используются в различных областях, включая медицину, электронику и сельское хозяйство.
Одним из основных моментов соединения щелочных металлов является их реактивность. Щелочные металлы очень активны и легко реагируют с кислородом и водой. При контакте с воздухом они образуют оксидные пленки, а при контакте с водой происходит сильное выделение водорода и образование щелочных гидроксидов.
Важным аспектом соединения щелочных металлов является их способность образовывать ионы. Щелочные металлы имеют один валентный электрон, который они легко отдают, образуя положительно заряженные ионы. Эта способность образования ионов является основой для многих химических реакций и соединений.
В итоге, соединения щелочных металлов играют важную роль в нашей жизни. Они находят применение в различных областях, от медицины до электроники. Понимание основных моментов соединения щелочных металлов помогает в разработке новых материалов и технологий.
Особенности соединения щелочных металлов

1. Химическая активность: Щелочные металлы, такие как литий, натрий, калий и др., являются очень активными химическими элементами. Они быстро реагируют с кислородом, водой и другими веществами, что делает их важными реагентами в различных отраслях науки и промышленности. Их активность обусловлена тем, что они имеют один (валентность +1) электрон на внешнем энергетическом уровне.
2. Образование щелочных гидроксидов: При взаимодействии щелочных металлов с водой образуются щелочные гидроксиды. Например, при взаимодействии натрия с водой образуется гидроксид натрия и выделяется водород. Это реакция щелочного гидроксида с кислотным оксидом.
3. Реакция с кислородом: Щелочные металлы интенсивно реагируют с кислородом, образуя соответствующие оксиды. Например, литий сгорает в кислороде, образуя оксид лития. Такие реакции широко используются в пиротехнике для получения ярких вспышек.
4. Образование ионов: При реакции щелочных металлов с другими веществами происходит передача электронов, что приводит к образованию положительно заряженных ионов. Например, натрий при реакции с хлором образует положительно заряженные натриевые ионы.
5. Применение в быту и промышленности: Щелочные металлы широко используются в быту и промышленности. Например, натрий используется для производства щелочей, стекла и алюминия. Литий применяется в производстве аккумуляторов и лекарств. Калий используется в удобрениях и в производстве взрывчатых веществ.
Определение и химические свойства
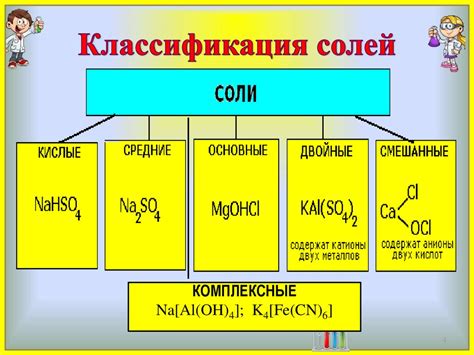
Щелочные металлы - это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются самыми активными химическими металлами из всех существующих.
Щелочные металлы обладают рядом общих химических свойств. Они легко окисляются воздухом и реагируют с водой, выделяясь водородом и образуя щелочные растворы. Такая реакция с водой носит название "гидролиз" и является одной из характерных особенностей щелочных металлов.
Щелочные металлы также образуют реакции с кислородом, образуя оксиды, которые являются основными соединениями этих элементов. Например, натрий образует оксид Na2O, калий - KO2, а литий - Li2O.
Важным свойством щелочных металлов является их способность образовывать соли. Щелочные металлы образуют стойкие соли с различными кислотами, например, хлориды, нитраты, сульфаты и другие. Эти соли часто применяются в промышленности и научных исследованиях.
Формы в которых встречаются щелочные металлы
Щелочные металлы являются химическими элементами, принадлежащими к первой группе периодической системы. Они встречаются в различных формах природного вещества, таких как минералы, соли, руды и растворы.
Одной из форм, в которых встречаются щелочные металлы, являются минералы. Например, кальцит, главным компонентом которого является кальций, является одним из основных минералов щелочных металлов. Щелочные металлы также могут быть представлены в виде других минералов, таких как биотит, гематит и ортоклаз.
Другой формой, в которой встречаются щелочные металлы, являются соли. Натрий и калий, например, находятся восприимчивыми к растворению в воде и могут быть найдены в виде различных солей. Натриевая соль, известная как обычная поваренная соль, является наиболее распространенным и широко используемым видом соли, содержащим натрий.
Щелочные металлы также могут быть обнаружены в рудах, таких как руда калия и руда лития. Эти руды содержат высокие концентрации соответствующих щелочных металлов и используются для добычи и производства соответствующих соединений и продуктов.
В растворах щелочные металлы также могут присутствовать в разных концентрациях и комбинациях. Например, раствор соды содержит натрий, а раствор калия содержит калий. Щелочные металлы в растворе могут реагировать с другими соединениями и играть важную роль в различных химических реакциях.
Процесс получения соединений щелочных металлов

Соединения щелочных металлов, таких как литий (Li), натрий (Na), калий (K) и др., являются важными веществами в химической промышленности и научных исследованиях. Процесс получения этих соединений включает несколько этапов.
Первый этап – добыча щелочного металла, который обычно происходит из естественных источников, таких как руды или солевые отложения. Затем происходит очистка металла от примесей, чтобы получить чистое вещество для дальнейшей обработки.
Второй этап – обработка щелочного металла для получения конкретного соединения. Это может быть проведено с помощью реакции металла с другими веществами, например, окислителями или кислотами. При этом образуются соли, оксиды или гидроксиды щелочных металлов.
Третий этап – очистка и переработка полученного соединения. Процесс может включать фильтрацию, дистилляцию или кристаллизацию, чтобы получить чистое и стабильное соединение щелочного металла.
После завершения всех этапов процесса получения соединений щелочных металлов, они могут использоваться в различных областях. Например, некоторые соединения Li используются в литий-ионных батареях, которые широко применяются в электроэнергетике и электронике. Соединения Na находят применение в производстве стекла, а соединения K используются в сельском хозяйстве в качестве удобрений.
Применение соединений щелочных металлов

Соединения щелочных металлов — это химические соединения, которые образуются при взаимодействии щелочных металлов, таких как литий, натрий, калий, с другими элементами. Эти соединения имеют широкое применение в различных областях, благодаря своим химическим и физическим свойствам.
Одним из наиболее распространенных применений соединений щелочных металлов является их использование в производстве щелочных батарей. Эти батареи широко применяются для питания устройств, таких как часы, пульты дистанционного управления, фонарики. В щелочных батареях щелочные металлы используются как активные компоненты, обеспечивающие электрическую энергию.
Другим важным применением соединений щелочных металлов является их использование в производстве стекла и керамики. Соединения щелочных металлов, такие как оксиды, карбонаты, используются в качестве добавок к сырью для стекольной и керамической промышленности. Они способствуют изменению физических и химических свойств материалов, а также улучшают их прочность и устойчивость к высоким температурам.
Еще одним важным применением соединений щелочных металлов является их использование в металлургии. Оксиды щелочных металлов используются в процессе выделения металлов из руды. Они служат в качестве флюса, понижая температуру плавления и улучшая сплавляемость металлов. Кроме того, натрий и калий используются для удаления кислорода из металлических сплавов в процессе сопряженного расплавления.
Значительное применение соединений щелочных металлов также находят в производстве синтетических веществ, пластиков, лекарственных препаратов и катализаторов. Каждая отрасль промышленности находит свои уникальные способы использования этих соединений, благодаря их разнообразным химическим свойствам и возможностям взаимодействия с другими веществами.
Основные моменты выбора соединений щелочных металлов
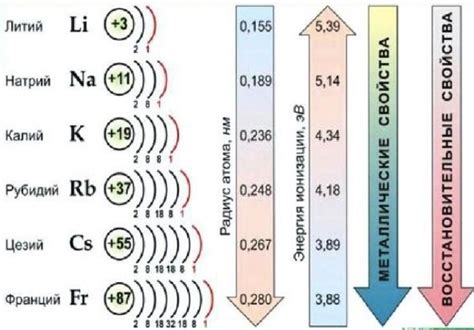
Щелочные металлы представляют собой группу элементов периодической системы, включающую литий, натрий, калий, рубидий, цезий и франций. Их свойства и реактивность обуславливаются электронной структурой и положением в периодической системе.
При выборе соединений щелочных металлов для конкретного применения следует учитывать такие факторы, как их физико-химические свойства, степень реакционной способности, стабильность в разных условиях, стоимость и доступность.
Одним из основных свойств щелочных металлов является их активность. Они легко взаимодействуют с водой, выделяя водород и образуя гидроксиды. Это свойство делает щелочные металлы полезными в различных областях промышленности, включая производство щелочей, стекла, синтеза органических соединений и производства аккумуляторов.
Однако, при использовании соединений щелочных металлов следует учитывать их реактивность и стабильность. Некоторые соединения могут быть очень реактивными и опасными при неправильном обращении с ними. Поэтому необходимо принимать меры предосторожности и соблюдать правила безопасности при работе с ними.
Важным фактором выбора соединений щелочных металлов является их стоимость и доступность. Некоторые соединения могут быть дорогими или труднодоступными из-за сложного процесса получения или низкой концентрации в природных рудах. Поэтому при выборе соединений следует учитывать эти факторы, чтобы получить оптимальное сочетание свойств и доступность материала.
Физические свойства щелочных металлов и их соединений

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают рядом особенных физических свойств.
Во-первых, щелочные металлы обладают низкой плотностью и низкой температурой плавления. Например, литий имеет плотность всего 0,534 г/см³ и температуру плавления всего 180 градусов Цельсия.
Во-вторых, щелочные металлы обладают высокой электропроводностью. Это связано с наличием свободных электронов в валентной оболочке, которые легко двигаются под воздействием электрического поля.
Кроме того, щелочные металлы обладают хорошей термической и химической стабильностью. Они не реагируют с воздухом и водой при обычных условиях.
Соединения щелочных металлов также обладают рядом интересных физических свойств. Например, многие из них образуют мощные основания и могут реагировать с кислотами, образуя соли.
Кроме того, соединения щелочных металлов могут обладать интересными светофизическими свойствами. Некоторые из них являются люминесцентными или фосфоресцентными, что находит применение в различных технологиях и приборах.
Способы хранения соединений щелочных металлов

Щелочные металлы, такие как литий, натрий, калий и др., являются весьма реактивными и подвержены окислению или реакции с влагой и воздухом. Поэтому способы хранения соединений щелочных металлов должны обеспечивать их защиту от этих воздействий.
Один из основных способов хранения - это использование металлических контейнеров, изготовленных из нержавеющей стали или специальных сплавов. Эти контейнеры обладают высокой стойкостью к коррозии и предотвращают проникновение влаги и воздуха.
Для сохранения безопасности и предотвращения аварийных ситуаций, соединения щелочных металлов часто хранятся в специальных хранилищах с контролируемой атмосферой. В таких местах поддерживается низкая влажность и отсутствие кислорода, что минимизирует риск окисления и реакций металлов с воздухом.
Также помимо верной упаковки и условий хранения, важно правильно маркировать контейнеры с соединениями щелочных металлов. На маркировках указываются все необходимые данные, включая название и формулу соединения, дату приготовления и информацию о безопасности. Это способствует идентификации и правильной эксплуатации вещества.
В целом, выбор и применение способа хранения соединений щелочных металлов зависит от их конкретных свойств и требований безопасности. Однако вне зависимости от выбранного метода, необходимо учитывать возможность реакций с влагой и воздухом, чтобы обеспечить долговечность и безопасность хранения щелочных металлов.
Вопрос-ответ

Какие есть основные моменты в соединении щелочных металлов?
В соединении щелочных металлов можно выделить несколько основных моментов. Во-первых, для соединения щелочных металлов необходимо использовать безводные вещества, так как они очень реакционны с водой. Во-вторых, щелочные металлы могут образовывать соединения с различными элементами, такие как кислород, сера, азот и др. В-третьих, при соединении щелочных металлов обычно происходит обмен электронами, что приводит к образованию ионных соединений.
Какие вещества нужно использовать для соединения щелочных металлов?
Для соединения щелочных металлов необходимо использовать безводные вещества, так как они очень реакционны с водой. Это могут быть вещества, такие как безводный хлорид натрия (NaCl), безводный оксид лития (Li2O) и т.д. Безводные вещества обладают высокой степенью реакционности, что позволяет проводить процесс соединения щелочных металлов более эффективно.
Какие соединения могут образовываться при соединении щелочных металлов?
При соединении щелочных металлов обычно образуются соединения с различными элементами. Например, щелочные металлы могут образовывать соединения с кислородом, серой, азотом и др. К примеру, натрий может образовывать соединения с кислородом, такие как оксид натрия (Na2O) или пероксид натрия (Na2O2). Литий может образовывать соединения с азотом, такие как нитрид лития (Li3N) и т.д. Такие соединения имеют различные свойства и применяются в различных областях науки и техники.
Как происходит образование соединений щелочных металлов?
При соединении щелочных металлов обычно происходит обмен электронами, что приводит к образованию ионных соединений. Щелочные металлы имеют один валентный электрон во внешней оболочке, который они готовы отдать, чтобы стать ионом положительного заряда. Например, натрий (Na) готов отдать свой валентный электрон при взаимодействии с кислородом (O), чтобы образовать ион натрия (Na+) и ион оксида (O2-). Такие ионы соединяются, образуя ионное соединение, например, оксид натрия (Na2O).
