Реакция концентрированных кислот с металлами является одной из основных химических реакций, которые изучаются в химическом анализе и химическом образовании. Эта реакция возникает при взаимодействии металла с кислотой, что приводит к образованию соответствующей соли и выделению водорода.
Реакция концентрированных кислот с металлами может быть представлена в виде общего химического уравнения:
Металл + Кислота → Соль + Водород
Исключением из этого общего уравнения является реакция с металлами из группы платиновых металлов (золото, платина, серебро), которые не реагируют с концентрированными кислотами.
Примерами реакций концентрированных кислот с металлами могут служить:
1. Реакция кислородной кислоты с цинком:
H2SO4 + Zn → ZnSO4 + H2
При взаимодействии серной кислоты с цинком образуется сульфат цинка и выделяется водород.
2. Реакция соляной кислоты с алюминием:
6 HCl + 2 Al → 2 AlCl3 + 3 H2
При взаимодействии соляной кислоты с алюминием образуется хлорид алюминия и выделяется водород.
3. Реакция азотной кислоты с медью:
4 HNO3 + Cu → Cu(NO3)2 + 2 H2O + 2 NO2
При взаимодействии азотной кислоты с медью образуется нитрат меди, вода и выделяется двуокись азота.
Таким образом, реакция концентрированных кислот с металлами является простым и важным явлением, которое может быть использовано для идентификации металлов и получения солей.
Как концентрированные кислоты взаимодействуют с металлами
Концентрированные кислоты обладают сильным окислительным свойством и способны взаимодействовать с металлами. При этом происходит образование солей и выделение водорода. Реакция происходит в результате разрушения металлической структуры и образования ионов металла с положительным зарядом.
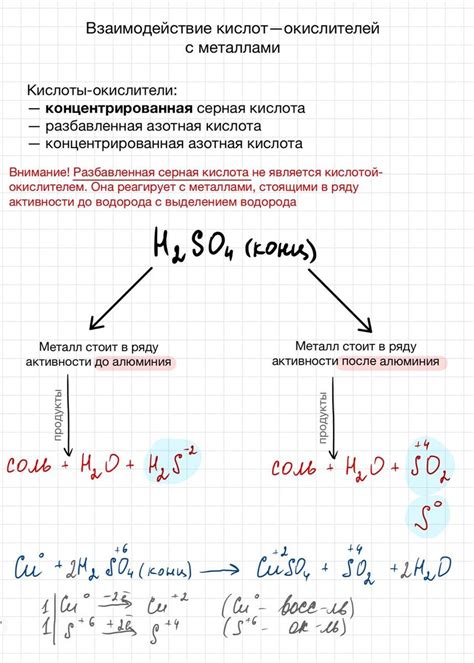
Взаимодействие концентрированных кислот с металлами зависит от активности металла. Например, сильная концентрированная серная кислота (H₂SO₄) реагирует с активными металлами, такими как натрий (Na) или калий (K), с выделением водорода и образованием солей сульфатов. При этом реакция протекает взрывоопасным образом и может сопровождаться выделением тепла и газа.
Более пассивные металлы, такие как железо (Fe) или цинк (Zn), реагируют с концентрированной соляной кислотой (HCl), образуя хлорид металла и высвобождая водород. Реакция с концентрированной азотной кислотой (HNO₃) приводит к образованию нитратов металлов и выделению водорода.
В общем случае, взаимодействие концентрированных кислот с металлами протекает по общей схеме: металл + кислота → соль + водород. Однако, следует помнить, что реактивность металла и концентрация кислоты могут существенно влиять на скорость и характер реакции, что необходимо учитывать при проведении химических экспериментов.
Таблица реакций концентрированных кислот с металлами

Реакция между концентрированными кислотами и металлами может протекать различными способами, проявляясь в виде взаимного обмена ионами. Реакционная способность кислот зависит от их кислотной силы, а также от активности металла.
Например, при контакте с концентрированной серной кислотой (H2SO4) активные металлы, такие как железо (Fe), цинк (Zn) и алюминий (Al), реагируют с образованием солей и выделением водорода (H2). Реакции можно записать следующим образом:
- Fe + H2SO4 → FeSO4 + H2
- Zn + H2SO4 → ZnSO4 + H2
- 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
С другими металлами, такими как медь (Cu), свинец (Pb) и серебро (Ag), реакция серной кислоты не происходит, так как они имеют меньшую реакционную способность.
Аналогичные примеры реакций можно привести и для других концентрированных кислот, таких как соляная кислота (HCl) и азотная кислота (HNO3). В каждом случае реакция будет зависеть от конкретной кислоты и металла, а также их концентраций.
Примеры реакций концентрированных кислот с металлами

При взаимодействии концентрированных кислот с металлами происходят химические реакции, в результате которых образуются соли и водород. Реакции зависят от свойств кислот и металлов, а также их концентрации. Рассмотрим некоторые примеры таких реакций.
1. Реакция соляной кислоты (HCl) с металлами:
- HCl + Zn → ZnCl2 + H2
- HCl + Fe → FeCl2 + H2
- HCl + Al → AlCl3 + H2
В результате этих реакций образуются хлориды металлов и молекула водорода.
2. Реакция азотной кислоты (HNO3) с металлами:
- 3HNO3 + Al → Al(NO3)3 + 3H2O + NO
- 4HNO3 + Cu → Cu(NO3)2 + 2H2O + 2NO2
- 6HNO3 + Zn → Zn(NO3)2 + 3H2O + 4NO2
В результате этих реакций образуются нитраты металлов, вода и оксиды азота.
3. Реакция серной кислоты (H2SO4) с металлами:
- H2SO4 + Mg → MgSO4 + H2
- H2SO4 + Zn → ZnSO4 + H2
- H2SO4 + Fe → FeSO4 + H2
В результате этих реакций образуются сульфаты металлов и молекула водорода.
Таким образом, реакции концентрированных кислот с металлами приводят к образованию солей и выделению водорода и/или других продуктов. Эти реакции широко используются в химической промышленности и лабораторных исследованиях.
Вопрос-ответ

Какие кислоты реагируют с металлами?
Многие кислоты способны реагировать с металлами, особенно если они концентрированные. Примерами таких кислот являются соляная кислота (HCl), серная кислота (H2SO4) и азотная кислота (HNO3).
Каким образом происходит реакция металлов с кислотами?
Когда металл вступает в контакт с кислотой, происходит окислительно-восстановительная реакция. В этом процессе металл отдает электроны, образуя ионы металла, а водородные ионы из кислоты принимают эти электроны, образуя молекулы водорода (H2). Например, при реакции цинка (Zn) с соляной кислотой (HCl), образуется хлорид цинка (ZnCl2) и молекулы водорода.
