Концентрированная серная кислота является сильным окислителем и обладает способностью реагировать с различными веществами. Одним из таких веществ являются оксиды металлов.
Оксиды металлов - это химические соединения, состоящие из металла и кислорода. Они обладают различной степенью окисления металла и имеют разные свойства. При взаимодействии с концентрированной серной кислотой происходят разнообразные реакции, в результате которых образуются соли и вода.
Одна из самых характерных реакций, которая происходит между серной кислотой и оксидами металлов, - это образование соответствующих солей. Например, реакция между серной кислотой и оксидом меди приводит к образованию сульфата меди и воды:
СuО + H₂SO₄ → СuSO₄ + H₂O
Реакция также может происходить с образованием сульфатов других металлов, таких как оксид железа(III), оксид алюминия и т.д.
Реакции между концентрированной серной кислотой и оксидами металлов являются важными в химической промышленности и используются для получения различных продуктов.
Свойства концентрированной серной кислоты

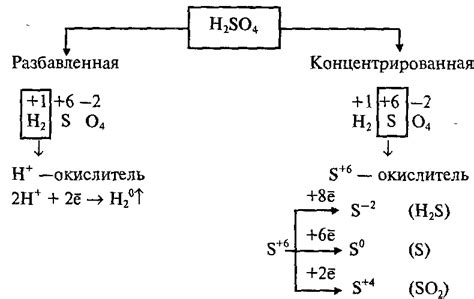
Концентрированная серная кислота (H2SO4) — это очень сильная и агрессивная кислота, которая обладает рядом особых свойств.
- Концентрированная серная кислота обладает высокой степенью диссоциации в воде. Она способна отдавать два протона, что обеспечивает ей сильную кислотность.
- Она является чрезвычайно коррозионно-активной и имеет способность реагировать с большим количеством веществ, включая оксиды металлов.
- Концентрированная серная кислота обладает высокой плотностью и вязкостью, что делает ее очень плотной и тяжелой жидкостью.
- Она обладает способностью окрашивать органические вещества, причиняя им повреждения или разрушение.
- Концентрированная серная кислота обладает очень высокой теплоемкостью, поэтому при реакциях с веществами сопровождается выделением значительного количества тепла.
Также, необходимо упомянуть, что концентрированная серная кислота представляет серьезную опасность для человека. При попадании на кожу она вызывает ожоги и может привести к серьезным повреждениям. Поэтому, при работе с этой кислотой необходимо соблюдать особые меры предосторожности и работать в хорошо проветриваемых помещениях.
Реакция серной кислоты с оксидами металлов
Серная кислота является одним из наиболее распространенных и важных химических соединений. Она обладает сильно кислыми свойствами и может реагировать с различными веществами, включая оксиды металлов.
Реакция серной кислоты с оксидами металлов происходит по общей схеме, которая может быть представлена следующим уравнением:
H2SO4 + MO → MSO4 + H2O
Здесь M обозначает металл, а MSO4 - соответствующую сернокислую соль.
Эта реакция является химической реакцией нейтрализации, при которой серная кислота отбирает у металла оксиген и образует сернокислую соль. Избыток серной кислоты может привести к образованию сернокислого газа, что необходимо учитывать при проведении данной реакции.
Реакция серной кислоты с оксидами металлов широко используется в химических технологиях, в процессе получения соединений металлов и в других промышленных процессах. Также она является важной реакцией в аналитической химии, позволяющей определить наличие и количество оксидов металлов в различных образцах.
Образование соль + вода

В результате реакции концентрированной серной кислоты с оксидами металлов образуется соль и вода. Эта реакция является типичной для многих оксидов металлов и серной кислоты.
При смешивании серной кислоты с оксидами металлов происходит образование соответствующей соли. Соль образуется из-за того, что кислота отнимает у оксида металла кислород, а металл связывает оставшуюся серу. Таким образом, образуется структура, которая называется солью.
Воду в данной реакции можно рассматривать как продукт. Она образуется при реакции серной кислоты с оксидами металлов. Вода образуется за счет того, что серная кислота содержит водород, который при реакции с оксидом металла превращается в воду.
Таким образом, реакция концентрированной серной кислоты с оксидами металлов приводит к образованию соли и воды. Этот процесс является важным для понимания химических свойств оксидов металлов и их реакций с кислотами.
Химические свойства полученных солей
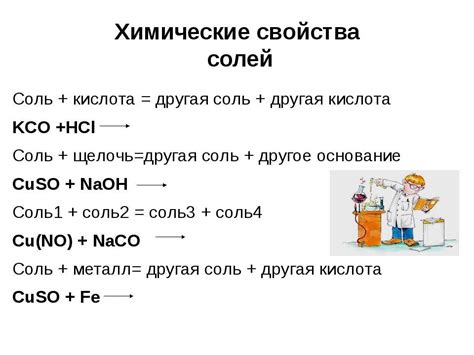
Полученные соли, образованные в результате реакции концентрированной серной кислоты с оксидами металлов, обладают рядом химических свойств, которые определяют их поведение в различных условиях.
Во-первых, соли могут образовать растворы с разными степенями ионизации в воде. Это зависит от ионной природы металла и кислотного остатка. Некоторые соли полностью диссоциируют, образуя ионы в растворе, а другие образуют меньшее количество ионов.
Во-вторых, соли проявляют различную степень реакционной способности. Некоторые соли могут участвовать в химических реакциях, образуя новые соединения или проявляя другие виды активности. Например, соли металлов могут образовать сложные соединения с различными кислотными радикалами.
В-третьих, соли могут быть хорошими промежуточными продуктами в процессе получения других соединений и материалов. Благодаря своей устойчивости и химической активности, соли могут быть использованы в химической промышленности для получения различных продуктов – от лекарств и удобрений до красителей и природных камней.
Таким образом, полученные соли в результате реакции концентрированной серной кислоты с оксидами металлов обладают разнообразными химическими свойствами, которые определяют их важность и применение в различных областях науки и промышленности.
Способы применения полученных солей
Соли, образующиеся при реакции концентрированной серной кислоты с оксидами металлов, имеют широкое применение в различных областях жизни.
Первым способом применения является использование полученных солей в производстве удобрений. Многие из них содержат необходимые макро- и микроэлементы, которые являются важными питательными веществами для растений. Соли, такие как сульфаты или нитраты металлов, могут быть использованы для повышения плодородия почвы и улучшения качества урожая.
Вторым способом применения является использование солей в производстве различных материалов. Например, сульфат меди используется для производства электролитического меди, которая широко применяется для производства электроники, электротехники и других отраслей промышленности. Сульфат цинка используется в производстве различных фармацевтических препаратов, красителей и пигментов.
Третий способ применения заключается в использовании солей в химических процессах. Например, хлорид меди применяется в производстве медицинских препаратов, раствор треххлорида железа используется в гальванической обработке металлов, а хлорид натрия является основным компонентом в производстве пищевых добавок и промышленных солей для омолаживающих ванн.
Список применения полученных солей может быть продолжен еще долго. Они находят применение в различных отраслях промышленности, медицине, сельском хозяйстве и других областях. Полученные соли являются важными химическими соединениями, которые способствуют развитию различных сфер жизни и обеспечивают более эффективное использование доступных ресурсов.
Влияние температуры на реакцию

Реакция концентрированной серной кислоты с оксидами металлов происходит с выделением тепла. Помимо химических свойств реагирующих веществ, температура также оказывает влияние на скорость и эффективность этой реакции.
Обычно, повышение температуры приводит к активации молекул и ионов, что способствует ускорению химических реакций. Также повышение температуры увеличивает энергию столкновения между реагирующими частицами, что повышает вероятность успешного соударения и образования новых промежуточных соединений.
Однако, при экстремально высоких температурах, взаимодействие концентрированной серной кислоты и оксидов металлов может протекать неэффективно или даже привести к нежелательным побочным реакциям. Например, при слишком высоких температурах может происходить огниво, которое приводит к газообразным выбросам и опасным условиям для проведения реакции.
Следует отметить, что каждая конкретная реакция между серной кислотой и оксидами металлов имеет свою оптимальную температуру, при которой она протекает наиболее эффективно. Это может зависеть как от свойств конкретных веществ, так и от условий проведения реакции. Поэтому, для достижения оптимальных результатов, необходимо проводить эксперименты с различными температурами и анализировать полученные данные.
Применение серной кислоты и ее солей в промышленности
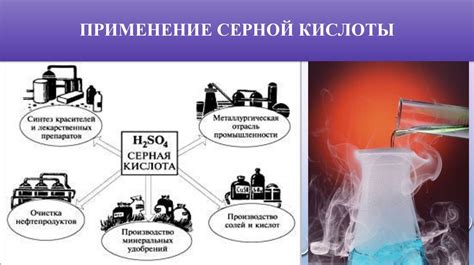
Серная кислота (H2SO4) и ее соли широко применяются в различных отраслях промышленности благодаря их уникальным химическим свойствам.
Одним из основных применений серной кислоты является ее использование в производстве минеральных удобрений. Серная кислота используется для получения серных удобрений, которые являются важным источником серы для растений. Они повышают плодородие почвы, способствуют росту и развитию растений, а также улучшают качество и урожайность сельскохозяйственных культур.
Кроме того, серная кислота применяется в производстве аккумуляторных батарей. Она используется для формирования электролита, который обеспечивает химическую реакцию внутри аккумулятора. Благодаря этому, аккумуляторы на основе серной кислоты способны хранить и отдавать большое количество электрической энергии, что делает их незаменимыми в многих сферах, включая автомобильную и солнечную энергетику.
Еще одной важной сферой применения серной кислоты и ее солей является производство химических веществ. Они используются в качестве катализаторов, растворителей и сырья для получения различных продуктов, включая пластмассы, красители, взрывчатые вещества, фармацевтические средства и многое другое. Благодаря высокой химической активности серной кислоты и ее солей, возможно получение широкого спектра химических продуктов с различными свойствами и применением.
Вопрос-ответ

Какую реакцию происходит между концентрированной серной кислотой и оксидами металлов?
При взаимодействии концентрированной серной кислоты с оксидами металлов обычно происходит реакция образования соли и воды. Это связано с тем, что серная кислота является двухосновной кислотой и может отдавать два протона. Оксиды металлов, в свою очередь, являются основаниями и могут принимать протоны. Таким образом, образуется соль металла с серной кислотой и молекулы воды.
Может ли концентрированная серная кислота реагировать со всеми оксидами металлов?
Концентрированная серная кислота может реагировать со многими оксидами металлов, однако не со всеми. Реакция зависит от активности металла: наиболее активные металлы вступают в реакцию с серной кислотой, образуя соли и воду. Однако менее активные металлы, такие как золото или платина, не реагируют с серной кислотой.
Что происходит с оксидами металлов при реакции с концентрированной серной кислотой?
При реакции с концентрированной серной кислотой оксиды металлов обычно превращаются в соответствующие соли. Например, оксид железа Fe2O3 реагирует с H2SO4, образуя соль серной кислоты Fe2(SO4)3 и воду. Это связано с тем, что серная кислота обладает высокими окислительными свойствами и может окислять металлы.
Какие продукты образуются при реакции концентрированной серной кислоты с оксидами металлов?
При реакции концентрированной серной кислоты с оксидами металлов образуются соли металлов и молекулы воды. Например, оксид железа Fe2O3 реагирует с H2SO4, образуя соль серной кислоты Fe2(SO4)3 и воду. Образование соли происходит за счет обмена металла на водородный ион в кислоте.
