Электродные потенциалы являются важной характеристикой электрохимических процессов, определяющей направление протекания реакции и скорость электрохимических переходов. Особую роль в формировании электродного потенциала играют ионы металлов, которые присутствуют в растворе. Концентрация этих ионов может значительно влиять на электродные потенциалы и электрохимические процессы.
Высокая концентрация ионов металлов может привести к изменению электродного потенциала и, как следствие, к возникновению внутреннего испарения металла из электрода. При этом процессы окисления и восстановления становятся более сложными, так как увеличивается концентрация ионов в растворе. В некоторых случаях, при определенных условиях, металлы могут образовывать сложные соединения с ионами других металлов, что также может привести к изменению электродного потенциала.
Однако, снижение концентрации ионов металлов может стабилизировать электродный потенциал и упростить электрохимические процессы. Меньшая концентрация ионов позволяет электроду более свободно осуществлять перенос электронов и участвовать в реакциях окисления и восстановления. Это может быть особенно важно для реакций, происходящих на поверхности электродов в электрохимических системах.
Влияние концентрации ионов металлов на электродные потенциалы является важным аспектом для понимания электрохимических процессов и может быть использовано для оптимизации электрохимических систем и разработки новых технологий.
Роль ионов металлов в электродных потенциалах
Электродные потенциалы играют важную роль в процессах электрохимической реакции и определяют направление ионного течения. Одним из факторов, влияющих на электродные потенциалы, является концентрация ионов металлов.
Ионы металлов являются активными участниками электрохимических реакций и могут быть приняты или переданы в процессе электродного окисления или восстановления. Концентрация ионов металлов влияет на скорость реакции и на направление потока электронов, что, в свою очередь, определяет электродный потенциал.
При повышении концентрации ионов металлов в растворе, увеличивается скорость электрохимической реакции. Это связано с тем, что большее количество активных частиц увеличивает вероятность столкновений и, следовательно, ускоряет процесс. Кроме того, повышение концентрации ионов металлов может изменить состав электродного слоя и, таким образом, повлиять на его электродный потенциал.
Обратно, понижение концентрации ионов металлов в растворе может замедлить электрохимическую реакцию, так как вероятность столкновений между активными частицами уменьшается. Это может привести к изменению электродного потенциала, в зависимости от реакции и специфических условий проведения эксперимента.
Таким образом, концентрация ионов металлов играет важную роль в электродных потенциалах, определяя скорость реакции и направление потока электронов. Исследование влияния концентрации металлических ионов на электродные потенциалы имеет практическое значение для различных областей, включая электрохимические процессы, гальванические элементы и электрокатализ.
Взаимосвязь концентрации ионов металлов и электродных потенциалов

Концентрация ионов металлов и электродные потенциалы являются тесно взаимосвязанной парой. Когда концентрация ионов металлов в растворе изменяется, это влияет на электродные потенциалы при реакциях окисления и восстановления на электродах.
Ионные реакции, происходящие на электродах, зависят от концентрации ионов металлов в растворе. При увеличении концентрации ионов металлов, электродный потенциал увеличивается. Это объясняется тем, что с увеличением концентрации ионов металлов, количество доступных реагентов для окисления или восстановления также возрастает, что приводит к усилению ионных реакций на электродах.
Однако, есть некоторые исключения. Некоторые ионы металлов могут образовывать комплексные соединения с другими веществами, что может снизить их активность и уменьшить электродный потенциал. Например, образование комплексного соединения с аммиаком может способствовать снижению активности ионов металла и, соответственно, снизить электродный потенциал.
Для определения точного влияния концентрации ионов металлов на электродные потенциалы необходимо учитывать и другие факторы. Факторы, такие как температура, давление и другие ионы в растворе, также могут влиять на электродные потенциалы. Поэтому полная картина влияния концентрации ионов металлов на электродные потенциалы может быть достигнута только при учете всех этих факторов.
- Итак, взаимосвязь концентрации ионов металлов и электродных потенциалов является сложной и многогранной.
- Изменение концентрации ионов металлов в растворе влияет на электродные потенциалы при реакциях окисления и восстановления на электродах.
- Некоторые ионы металлов могут образовывать комплексные соединения, что может изменить их активность и электродный потенциал.
- На электродные потенциалы также влияют другие факторы, такие как температура, давление и присутствие других ионов в растворе.
Физико-химический механизм влияния ионов металлов на электродные потенциалы

Электродные потенциалы являются важными характеристиками электрохимических систем и имеют определенное значение для различных процессов, включая электролиз и коррозию. Одним из факторов, влияющих на электродные потенциалы, является концентрация ионов металлов.
Физико-химический механизм влияния ионов металлов на электродные потенциалы заключается в изменении активности металла в электрохимической системе. Увеличение концентрации ионов металла приводит к увеличению их активности и, соответственно, к изменению электродного потенциала. Это связано с изменением скорости окислительно-восстановительных реакций на электроде, которые определяют электродный потенциал.
Более конкретно, повышение концентрации ионов металла увеличивает скорость восстановления металла на электроде, что приводит к смещению электродного потенциала в отрицательную сторону. Напротив, снижение концентрации ионов металла снижает скорость восстановления металла и смещает электродный потенциал в положительную сторону.
Этот механизм объясняет, почему электродный потенциал может сильно зависеть от концентрации ионов металла в электролите. Таким образом, контроль концентрации ионов металла является важным фактором при проектировании электрохимических систем и их электродов.
Электродные потенциалы ионов металлов в различных средах

Электродные потенциалы ионов металлов играют важную роль в химических реакциях и определяют их термодинамическую возможность. В различных средах металлы проявляют различные электродные потенциалы, что зависит от условий окружающей их среды и концентрации ионов.
Концентрация ионов в растворе может значительно влиять на электродные потенциалы металлов. При повышении концентрации ионов металлов в растворе, электродный потенциал таких металлов может снижаться. Это объясняется электростатическим взаимодействием между ионами металла и другими ионами в растворе.
На электродные потенциалы металлов также может влиять pH среды. Известно, что некоторые металлы имеют различные окислительные и восстановительные свойства в разных средах. Например, ион железа в водных растворах имеет различные степени окисления в зависимости от pH среды. Это связано с изменением концентрации протонов в растворе и их влиянием на реакцию окисления-восстановления.
Для изучения электродных потенциалов металлов в различных средах часто используют электрохимические методы, такие как потенциостатический анализ и циклическая вольтамперометрия. Эти методы позволяют определить зависимость электродного потенциала от концентрации и pH среды и получить качественные и количественные данные о взаимодействии ионов металлов с раствором.
В заключение, электродные потенциалы ионов металлов в различных средах зависят от концентрации и pH раствора. Изучение этих потенциалов имеет важное значение для понимания химических реакций, происходящих в окружающей нас среде и в лабораторных условиях.
Специфичность влияния разных металлов на электродные потенциалы

Металлы играют важную роль в электрохимических процессах и влияют на электродные потенциалы. Однако, каждый металл обладает своей специфичностью воздействия на электродные потенциалы. Это обусловлено различиями в химических и электрохимических свойствах металлов.
Парамагнитные металлы (например, железо, никель, кобальт) характеризуются наличием нескольких возможных окислительных состояний, что может приводить к изменению электродного потенциала в зависимости от окружающей среды. Кроме того, некоторые металлы, такие как медь или цинк, способны образовывать сложные ионы с разными степенями окисления, что также влияет на их электродный потенциал.
Переходные металлы (например, мышьяк, ртуть, свинец) обладают специфичным влиянием на электродные потенциалы. Они могут образовывать различные соединения в разных окислительных состояниях, что влияет на их электродный потенциал. Кроме того, переходные металлы могут образовывать комплексные ионы с разными степенями окисления и различными лигандами, что также влияет на их электродные потенциалы.
Драгоценные металлы (например, золото, платина, серебро) обладают особым влиянием на электродные потенциалы. Они обычно характеризуются высокой стабильностью окислительных состояний и низкой склонностью к окислению или восстановлению. Из-за своей низкой реактивности, драгоценные металлы имеют стабильные электродные потенциалы, что делает их полезными в приложениях, требующих точного измерения и контроля потенциалов.
Таким образом, специфичность влияния разных металлов на электродные потенциалы обусловлена их химическими и электрохимическими свойствами. Различия в окислительных состояниях, способность образовывать сложные ионы и особенности реакций окисления и восстановления делают каждый металл уникальным в своем влиянии на электродные потенциалы.
Градиент концентрации и его влияние на электродные потенциалы
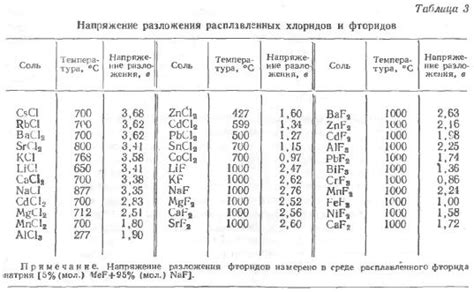
Градиент концентрации является одним из важных факторов, влияющих на электродные потенциалы в системе. Концентрационный градиент возникает, когда концентрация ионов металлов различна в разных точках реакционной среды. Этот градиент может быть как вертикальным (вдоль вертикальной оси), так и горизонтальным (вдоль горизонтальной оси).
Градиент концентрации оказывает сильное влияние на электродные потенциалы металлов. Всякий раз, когда концентрация ионов металлов меняется, меняется и электродный потенциал этого металла. Это связано с тем, что электродный потенциал зависит от активности ионов металлов в реакционной среде.
В случае вертикального градиента концентрации, электродный потенциал будет меняться в зависимости от высоты. Например, если концентрация ионов металла увеличивается внизу, то электродный потенциал будет выше, чем в верхних слоях. Это можно объяснить тем, что ионы металла в нижних слоях легче могут проникать на поверхность электрода и участвовать в электрохимических реакциях.
В случае горизонтального градиента концентрации, электродный потенциал будет меняться в зависимости от расстояния. Например, если концентрация ионов металла увеличивается справа налево, то электродный потенциал будет выше на правой стороне. Это связано с тем, что ионы металла в правых слоях будут легче проникать на поверхность электрода и участвовать в электрохимических реакциях.
Таким образом, градиент концентрации играет важную роль в определении электродных потенциалов металлов в системе. Изучение и учет данного фактора позволяет более точно предсказывать электрохимические процессы и электродные реакции в различных условиях и средах.
Практические применения влияния концентрации ионов металлов на электродные потенциалы
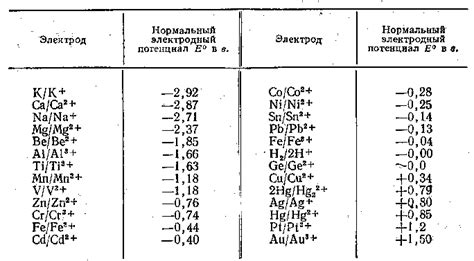
Изучение влияния концентрации ионов металлов на электродные потенциалы имеет множество практических применений. Этот феномен широко используется в различных областях науки и промышленности, включая аналитическую химию, электрохимию, гальванотехнику, металлургию и другие.
Одним из практических применений является использование электродных потенциалов для анализа концентрации ионов металлов в растворах. Этот метод особенно полезен в области экологии, где можно определить загрязнение воды различными тяжелыми металлами, такими как свинец, ртуть или кадмий. Для этого используются электроды, специально разработанные для измерения электродных потенциалов при разных концентрациях ионов металлов.
В области электрохимии влияние концентрации ионов металлов на электродные потенциалы позволяет управлять химическими реакциями, происходящими на электродах. Это применяется, например, при электрохимической обработке поверхностей материалов, приготовлении гальванических покрытий, процессах электролиза и даже в биологических системах, где электродные потенциалы играют важную роль в регуляции реакций в клетках.
Осознание влияния концентрации ионов металлов на электродные потенциалы также имеет огромное значение в металлургии. Например, в процессе плавки и легирования металлов концентрация ионов различных элементов может влиять на их физические и химические свойства. Путем контроля концентрации ионов металлов можно достичь требуемых характеристик и качества металлических материалов, таких как прочность, твердость, коррозионная стойкость и другие.
Исследование влияния концентрации ионов металлов на электродные потенциалы имеет огромное практическое значение для широкого спектра отраслей, от научных исследований до промышленного производства. Это позволяет контролировать и регулировать физико-химические процессы, оптимизировать производственные процессы и создавать новые материалы с нужными свойствами. Поэтому понимание этого влияния является важной задачей для современной науки и технологии.
Влияние других факторов на электродные потенциалы при различной концентрации ионов металлов
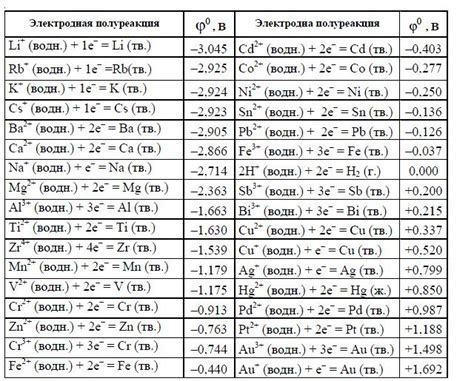
Помимо концентрации ионов металлов, на электродные потенциалы также влияют другие факторы. Один из таких факторов - температура. При повышении температуры, среда становится более активной и реакции на электродах протекают быстрее, что может привести к изменению электродного потенциала.
Еще одним важным фактором является наличие других ионов в растворе. Например, присутствие ионов кислорода может повлиять на процесс окислительно-восстановительных реакций на электродах и, как следствие, на электродный потенциал.
Также следует учитывать pH среды. Кислотность или щелочность раствора может изменить концентрацию свободных ионов металла, что, в свою очередь, повлияет на электродный потенциал.
Важным фактором, определяющим электродный потенциал, является также природа растворителя. Различные растворители могут взаимодействовать с ионами металла по-разному и вызывать изменение электродного потенциала.
Физическое состояние ионов металлов в растворе также может оказывать влияние на электродный потенциал. Например, ионы металла могут находиться в виде одноатомных ионов или в виде комплексных соединений, что может изменить их реакционную способность и, следовательно, электродный потенциал.
Перспективы исследования влияния концентрации ионов металлов на электродные потенциалы
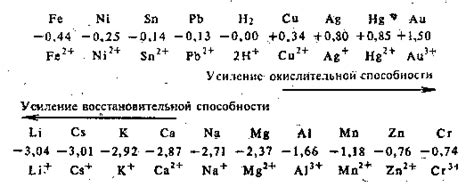
Исследование влияния концентрации ионов металлов на электродные потенциалы имеет большую перспективу в современной науке и технологии. Электродные потенциалы играют важную роль в множестве процессов, включая электрохимические реакции, гальванические элементы, катодную и анодную защиту, сенсоры и другие приложения.
Исследования позволяют определить зависимость электродного потенциала от концентрации ионов металлов, что помогает понять основные механизмы процессов электрохимии и разработать более эффективные методы и технологии. Среди возможных исследовательских направлений можно выделить изучение различных легированных материалов, включая сплавы и композиты, а также исследование поведения ионов металлов в различных электролитах.
Проведение таких исследований позволяет выявить оптимальные условия для различных электрохимических процессов, оптимизировать производственные процессы, улучшить эффективность различных устройств и систем. Кроме того, понимание влияния концентрации ионов металлов на электродные потенциалы может иметь важное значение для разработки новых материалов с уникальными свойствами и повышенной стабильностью.
Таким образом, исследование влияния концентрации ионов металлов на электродные потенциалы представляет собой актуальную и перспективную область научных исследований, которая имеет важное значение для развития современной электрохимии и технологии.
Вопрос-ответ

Как влияет концентрация ионов металлов на электродные потенциалы?
Концентрация ионов металлов имеет прямое влияние на электродные потенциалы. Повышение концентрации ионов металла приводит к увеличению электродного потенциала и наоборот, снижение концентрации - к его снижению.
Какие металлы больше всего подвержены влиянию концентрации ионов на их электродные потенциалы?
Разные металлы могут иметь разную чувствительность к изменениям концентрации ионов. Однако обычно металлы с более высокими электродными потенциалами, такие как платина, золото и серебро, относительно более устойчивы к изменениям концентрации ионов, чем металлы с более низкими потенциалами.
