Изучение взаимодействия металлов и неметаллов с окружающей средой является одной из кладезей знаний в области химии. Основным аспектом этой проблематики является определение количества электронов, которые отдают металл и неметалл при своем взаимодействии.
Следует отметить, что металлы характеризуются тем, что во внешней электронной оболочке у них находится малое количество электронов, часто равное 1-3. Это значит, что металлы готовы легко отдать свои электроны и образовать положительно заряженные ионы, их конфигурации повторяют конфигурацию инертного газа.
Неметаллы, в отличие от металлов, обладают большим количеством электронов во внешней электронной оболочке, часто равном 4-8. Это означает, что неметаллы имеют высокую электроотрицательность и образуют отрицательно заряженные ионы, забирая электроны у других элементов. Таким образом, неметаллы стремятся закончить свою электронную оболочку и при этом стать структурой инертного газа.
Таким образом, определение количества электронов, отдаваемых металлом и неметаллом, является важным аспектом изучения их химических свойств. Из-за различных количеств электронов во внешней электронной оболочке металлы и неметаллы обладают совершенно разной химической активностью и способностью образовывать соединения.
Металлы

Металлы - это класс веществ, обладающих высокой электропроводностью, гибкостью, теплопроводностью и блеском. Они являются одной из основных групп элементов в периодической системе Менделеева. Металлы обычно являются твердыми при комнатной температуре (за исключением ртути) и способны проводить электрический ток.
В периодической системе Менделеева металлы обычно располагаются слева от линии, разделяющей металлы и неметаллы. Однако, некоторые элементы, такие как гидроген, амфор, поласт, некоторые бориды, сульфиды, фосфиды и оксиды, также могут проявлять свойства металлов, хотя формально они принадлежат к неметаллам.
Самопроизвольно отдаваемые электроны определяют высокую электропроводность металлов. Закономерности данного процесса описываются моделью свободных электронов, которая предполагает наличие в металлах свободных электронов, свободно движущихся внутри кристаллической решетки.
Большинство металлов имеют типическую металлическую структуру, состоящую из кристаллической решетки, в которой служит основная роль упаковка атомов металла, а свободные электроны между атомами служат "скрепкой". Кристаллография металлов определяет их физические и химические свойства, такие как пластичность, термостойкость и устойчивость к коррозии.
Неметаллы

Неметаллы – это класс химических элементов, которые не обладают металлическими свойствами. В таблице Менделеева неметаллы находятся справа от линии диагонали, которая разделяет металлы и неметаллы.
Неметаллы обладают разнообразными физическими и химическими свойствами. Они обычно являются хрупкими, недуктивными и плохо проводящими тепло и электричество. Неметаллы могут быть газообразными (как кислород и гелий), жидкими (как бром и йод) или твердыми (как углерод и сера) при комнатной температуре и нормальном давлении.
Неметаллы часто образуют химические соединения с металлами и другими неметаллами. Они могут образовывать ионные и ковалентные связи. Например, хлор (неметалл) образует ионы хлорида (Cl-) при взаимодействии с натрием (металл), а водород (неметалл) образует ковалентную связь с кислородом (неметалл) при образовании молекулы воды (H2O).
Неметаллы играют важную роль в химической промышленности, медицине, электронике и других областях. Они используются для производства полимеров, лекарств, электронных компонентов и других продуктов. Кроме того, неметаллы также играют важную роль в жизни организмов, так как они входят в состав биологических молекул, таких как протеины и нуклеиновые кислоты.
Влияние межатомных связей
Межатомные связи - это взаимодействие между атомами в молекулах, которое зависит от их энергии и расстояния между ними. От типа межатомных связей зависят многие свойства вещества, включая его химическую активность, температуру плавления и испарения, электропроводность и многие другие.
Существует несколько типов межатомных связей, включая ионные, ковалентные и металлические связи. Ионные связи образуются между атомами с разными электроотрицательностями, когда один атом отдает электроны другому. Ковалентные связи образуются между атомами, которые совместно используют электроны, образуя общие электронные пары. Металлические связи характерны для металлов и обусловлены свободными электронами, которые могут перемещаться между атомами.
Межатомные связи имеют решающее влияние на различные свойства вещества. Например, межатомные связи определяют электропроводность металлов, так как свободные электроны могут передвигаться по кристаллической решетке. В случае ионных связей, электрические заряды атомов обусловливают образование кристаллической решетки с определенной структурой. Ковалентные связи, в свою очередь, обеспечивают устойчивость молекул и определяют их химические свойства.
Изменение типа и силы межатомных связей может привести к драматическим изменениям в свойствах вещества. Например, изменение межатомных связей может привести к изменению состояния вещества от твердого до жидкого или газообразного. Также, изменение связей может привести к изменению температуры плавления и испарения, что может иметь важные практические применения.
Электроотрицательность
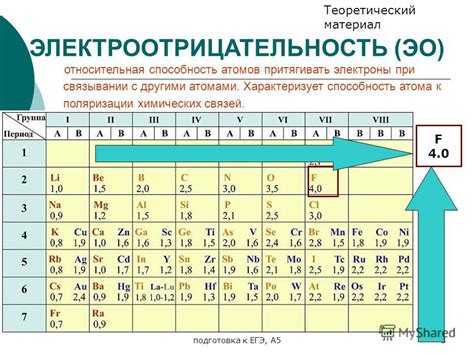
Электроотрицательность - это способность атома атомного элемента притягивать к себе электроны в химической связи. Она является физической характеристикой и определяется положительным числовым значением.
Электроотрицательность играет важную роль в определении химических свойств элементов. Чем выше электроотрицательность атома, тем сильнее он притягивает к себе электроны в химической связи.
Существуют различные шкалы электроотрицательности, наиболее часто используется шкала Полинга. На этой шкале наибольшую электроотрицательность имеет флуор, а наименьшую - цезий. Таким образом, флуор самый сильный электроотрицательный элемент, а цезий самый слабый.
Значение электроотрицательности определяет, каким образом атомы разных элементов будут взаимодействовать друг с другом. Если электроотрицательность двух атомов отличается значительно, то один элемент будет притягивать электроны к себе сильнее и образовываться полярная связь. Если разница электроотрицательностей небольшая, то связь будет неполярной.
В таблице Менделеева электроотрицательность атомов увеличивается по периоду слева направо и по группе снизу вверх. Электроотрицательность помогает объяснить химическую активность различных элементов и прогнозировать их химические соединения.
Энергия ионизации
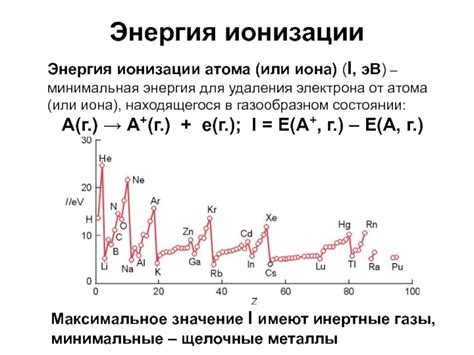
Энергия ионизации - это энергия, необходимая для того, чтобы оторвать электрон от атома или иона в его нейтральном состоянии. Количеством энергии, необходимой для ионизации атома, можно оценить его склонность к отдаче электрона или электронов.
Чем выше энергия ионизации атома, тем больше энергии нужно приложить для отрыва электрона от его атома или иона. Большая энергия ионизации обычно характерна для неметаллов, у которых высокая электроотрицательность и малый размер атома, что приводит к сильному притяжению электронов ядром.
Атомы металлов, с другой стороны, имеют меньшую электроотрицательность и более крупные размеры, что делает намного легче оторвать электроны от их атомов. Поэтому у металлов энергия ионизации обычно низкая.
Значение энергии ионизации может быть использовано для предсказания, какие атомы имеют склонность отдавать или получать электроны и, следовательно, какие атомы образуют ионы положительного или отрицательного заряда.
| Элемент | Энергия ионизации (кДж/моль) |
|---|---|
| Гелий | 2372 |
| Кислород | 1314 |
| Натрий | 495.8 |
| Хлор | 1251.2 |
Из примеров видно, что химические элементы с меньшей энергией ионизации (например, натрий и хлор) более вероятно образуют ионы положительного и отрицательного заряда соответственно.
Вопрос-ответ

Как определить количество электронов, которые отдаёт металл?
Количество электронов, которые отдаёт металл, можно определить по его электронной конфигурации. В металлах энергетический уровень, на котором находятся электроны, называется валентным. Обычно металлы отдают все электроны со своего валентного уровня. Так, например, у железа электронная конфигурация 1s2 2s2 2p6 3s2 3p6 4s2 3d6, и металл отдаёт 2 электрона со своего валентного уровня 4s2, чтобы достичь стабильности и превратиться в положительный ион Fe2+.
Почему металлы отдают электроны?
Металлы отдают электроны для того, чтобы достичь электронной конфигурации инертного газа. Инертные газы, такие как гелий, не реагируют с другими элементами, так как их электронные конфигурации являются наиболее стабильными. Металлы стремятся достичь такой же стабильности, отдавая лишние электроны. Когда металл отдаёт электроны, он превращается в положительно заряженный ион, который обычно обозначается "+", и эти электроны становятся доступными для других элементов, которые стремятся приобрести электроны.
Как определить количество электронов, которые отдаёт неметалл?
Количество электронов, которые отдаёт неметалл, можно определить по его электронной конфигурации. В неметаллах энергетический уровень, на котором находятся электроны, называется валентным. Неметаллы обычно принимают электроны, чтобы достичь стабильности, так как прием электронов позволяет им превратиться в отрицательные ионы, которые более стабильны. Например, хлор имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p5, и он принимает 1 электрон, чтобы достичь стабильности и превратиться в отрицательный ион Cl-, содержащий 17 электронов в оболочке.
