Для приготовления раствора с заданным титром по железу часто используется перманганат калия (KMnO4). Данный химический реагент широко применяется в лабораторных условиях для оценки содержания железа в различных образцах. В данной статье рассмотрим, сколько KMnO4 нужно приготовить для раствора объемом 5 дм3.
Первым шагом при приготовлении раствора KMnO4 является расчет необходимого количества вещества. Для этого необходимо знать заданный титр раствора по железу. Титр - это количество вещества, требуемое для полного окисления или восстановления другого вещества. В данном случае, возьмем для расчетов заданный титр равным 0,1 М.
Далее, для решения данной задачи, необходимо использовать уравнение реакции между KMnO4 и FeSO4. Уравнение имеет следующий вид:
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
По данному уравнению видно, что для окисления одной молекулы FeSO4 понадобится одна молекула KMnO4. Поэтому, чтобы рассчитать количество KMnO4 для приготовления 5 дм3 раствора, необходимо узнать численную концентрацию KMnO4 и провести простые математические расчеты.
Используемое оборудование и реактивы

Для приготовления 5 дм3 раствора с заданным титром по железу необходимо использовать следующее оборудование и реактивы:
- Стеклянные пробирки: используются для измерения объема растворов и проведения реакций.
- Мерный цилиндр: требуется для точного измерения объема жидкостей.
- Весы: используются для взвешивания реактивов нужной массы.
- Штатив с колбами: нужен для поддержки и нагревания реакционных сосудов.
Список реактивов для приготовления раствора может включать:
- KMnO4: калия перманганат используется в качестве окислителя.
- Кристаллическая серная кислота (H2SO4): служит для создания кислого среды, необходимой для протекания реакции.
- Железосодержащее вещество: может быть железо(II)сульфат, железо(II)аммонийсульфат или другое соединение, которое будет окислено перманганатом.
Приготовление раствора по заданному титру требует точного измерения масс реактивов и объемов жидкостей, а также соблюдение правил безопасности при работе с химическими веществами.
Методика приготовления раствора

Для приготовления раствора с заданным титром по железу необходимо использовать перманганат калия (KMnO4), который является окислителем. Этот раствор используется в аналитической химии для определения концентрации железа в различных образцах.
Перед началом приготовления раствора необходимо обеспечить безопасность работы. На этапе подготовки следует надеть защитные очки и перчатки, так как KMnO4 является веществом, которое может вызывать раздражение кожи и слизистых оболочек.
Окислительный раствор приготавливают следующим образом: сначала взвешивают определенное количество KMnO4 (в граммах) с точностью до милиграмма. Затем растворяют его в дистиллированной воде. Рекомендуется использовать мерную колбу объемом 5 дм3.
При приготовлении раствора необходимо помнить о правильном растворении KMnO4. Это вещество очень плохо растворимо в воде, поэтому для ускорения процесса можно использовать нагревание и помешивание. После полного растворения KMnO4 жидкость необходимо охладить до комнатной температуры.
После того как раствор окислителя приготовлен, следует определить его концентрацию. Для этого можно провести титрование раствора KMnO4 с раствором, содержащим известное количество вещества, окисляемого перманганатом калия. Результаты титрования позволяют определить концентрацию раствора KMnO4 и использовать его для приготовления раствора с заданным титром по железу.
Важно помнить, что приготовление и использование раствора с заданным титром по железу требуют точности и аккуратности. Необходимо следовать инструкциям и процедурам, чтобы получить правильный результат анализа и избежать ошибок.
Определение титра раствора по железу
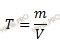
Определение титра раствора по железу является важным этапом химического анализа. Титром называется количество реактива, необходимое для полного окисления или восстановления определенного количества вещества. В данном случае речь идет о титрировании раствора с заданным титром по железу с помощью раствора KMnO4.
Для начала, необходимо знать заданный титр раствора по железу, который указывается в условиях задачи. Титр раствора представляет собой массу вещества, содержащегося в единице объема раствора. Для определения титра раствора по железу используется калий перманганат (KMnO4), который является сильным окислителем.
Определение титра раствора по железу происходит по принципу редокс-реакции, где перманганат и железо взаимодействуют с образованием соли марганца и железа. Реакция протекает в кислой среде. Для точного определения титра использование индикатора, такого как серный индиго, позволяет определить момент достижения эквивалентной точки реакции, когда все железо будет окислено до иона железа(III).
Для проведения определения титра раствора по железу, необходимо знать объем раствора, его концентрацию и титр раствора по железу. Используя примененные методики титрования, можно точно определить концентрацию и качество раствора по железу. Такие данные могут быть полезны при проведении различных аналитических исследований и контроле качества продукции.
Расчет необходимого количества KMnO4

Для приготовления 5 дм3 раствора с заданным титром по железу необходимо провести расчет необходимого количества KMnO4.
Для начала, необходимо установить требуемую концентрацию раствора KMnO4. Для этого используется титрование раствора пробной порции KMnO4 раствором, содержащим известное количество железа. Измеряется объем раствора KMnO4, который потребовался для полного окисления железа.
Исходя из данных титрования, можно рассчитать массу KMnO4, необходимую для приготовления 5 дм3 раствора с заданным титром по железу. Обычно используется реакция:
2MnO4- + 5Fe2+ + 8H+ → 2Mn2+ + 5Fe3+ + 4H2O
Из уравнения реакции видно, что для окисления одной моль железа (Fe2+) потребуется две моли KMnO4. Используя молярную массу KMnO4, можно рассчитать массу, соответствующую двум молям KMnO4. Затем, проводя простейшие пропорции, можно найти массу KMnO4, необходимую для приготовления 5 дм3 раствора с заданным титром по железу.
Вопрос-ответ

Как рассчитать количество KMnO4 для приготовления 5 дм3 раствора?
Для расчета количества KMnO4 для приготовления 5 дм3 раствора необходимо знать титр KMnO4 по железу. С помощью данного титра можно рассчитать количество KMnO4 по формуле: V(KMnO4) = V(железо) * T(KMnO4) * 5 / 1000, где V(KMnO4) - объем KMnO4, V(железо) - объем железа, T(KMnO4) - титр KMnO4.
Как найти титр KMnO4 по железу?
Для определения титра KMnO4 по железу необходимо провести титрование с железом. Титрование проводят с использованием раствора KMnO4 и индикатора, например, фенилглиоксальной кислоты. После титрования можно рассчитать титр KMnO4 по формуле: T(KMnO4) = V(железо) / V(KMnO4), где T(KMnO4) - титр KMnO4, V(железо) - объем железа, V(KMnO4) - объем KMnO4.
Что нужно для титрования KMnO4 с железом?
Для титрования KMnO4 с железом необходимо следующее оборудование и реактивы: раствор KMnO4, раствор железа, индикатор (например, фенилглиоксальная кислота), бюретка, конический колба, пипетки, аналитические весы, дистиллированная вода.
В какой единице измеряется титр KMnO4?
Титр KMnO4 обычно измеряется в моль/литр (М).
Как рассчитать количество KMnO4 для приготовления 5 дм3 раствора с заданным титром по железу?
Для расчета количества KMnO4 для приготовления 5 дм3 раствора с заданным титром по железу необходимо знать титр KMnO4 и объем железа. Количество KMnO4 можно рассчитать по формуле: масса KMnO4 = V(железо) * T(KMnO4) * 5 * mol_mass(KMnO4) / 1000, где масса KMnO4 - масса KMnO4, V(железо) - объем железа, T(KMnO4) - титр KMnO4, 5 - объем раствора, mol_mass(KMnO4) - молярная масса KMnO4.
