В химической системе элементов щелочноземельные металлы представлены группой элементов, обладающих общими характеристиками. Одной из особенностей этих металлов является то, что на их внешнем электронном слое находятся всего два электрона. Именно благодаря этому факту щелочноземельные металлы проявляют высокую активность в химических реакциях и способность образовывать стабильные ионные соединения.
Количество электронов на внешнем электронном слое влияет на физические и химические свойства элемента. В случае щелочноземельных металлов, их электронная конфигурация обуславливает их химическую активность, что приводит к их способности образовывать стабильные ионы с положительным зарядом.
Также стоит отметить, что в случае щелочноземельных металлов, количество электронов на внешнем электронном слое у всех элементов одинаково и составляет два электрона. Именно этот факт определяет их принадлежность к одной группе химических элементов. Кроме того, их особенности делают щелочноземельные металлы доступными для использования в различных областях человеческой жизни, начиная от промышленности и заканчивая медицинской наукой.
Итак, количество электронов на внешнем электронном слое у щелочноземельных металлов составляет два электрона, что определяет их химическую активность и способность образовывать ионы с положительным зарядом. Эта особенность делает щелочноземельные металлы значимыми в нашей жизни и активно применяемыми в различных отраслях.
Электроны на внешнем электронном слое

Электроны на внешнем электронном слое — это электроны, находящиеся на самом внешнем энергетическом уровне атома или иона. В щелочноземельных металлах, таких как бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra), на внешнем электронном слое находится два электрона.
На внешнем электронном слое находятся электроны, которые определяют химические и физические свойства атома или иона. Эти электроны называются валентными электронами и отвечают за взаимодействие атомов во время химических реакций.
Электроны на внешнем электронном слое обладают большим энергетическим потенциалом и могут участвовать в обмене электронами с другими атомами. Этот обмен электронами позволяет атомам образовывать химические связи и образовывать различные структуры, такие как молекулы или кристаллические решетки.
Щелочноземельные металлы обладают высокой реактивностью из-за своих двух валентных электронов на внешнем электронном слое. Они легко отдают эти электроны и образуют ионы с положительным зарядом, что позволяет им образовывать ионные соединения с атомами других элементов.
Валентные электроны на внешнем электронном слое щелочноземельных металлов играют важную роль во многих процессах, включая химические реакции, электрохимические процессы и электропроводность материалов.
Щелочноземельные металлы
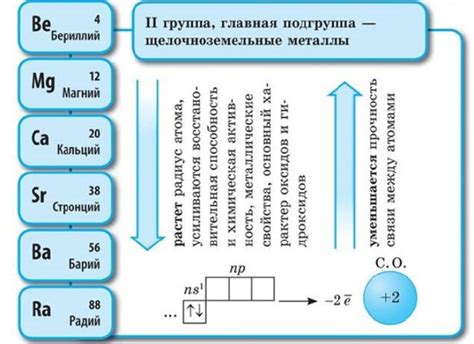
Щелочноземельные металлы - это группа элементов периодической системы, которая состоит из бериллия, магния, кальция, стронция, бария и радия. Эти металлы расположены во второй группе и характеризуются своими химическими свойствами. Они являются активными элементами, но менее реактивными, чем щелочные металлы.
Щелочноземельные металлы имеют два внешних электронных слоя, в которых располагается общее количество электронов: два электрона на внешнем слое и восемь электронов на втором слое. Это делает их электронную конфигурацию устойчивой и нестабильность проявляется лишь при отрыве двух электронов на внешнем слое для образования катионов.
Вакантные места на внешнем слое щелочноземельных металлов делают их химически активными. Они стремятся к образованию ионов с положительным зарядом, чтобы достигнуть стабильного состояния. Щелочноземельные металлы реагируют с водой, образуя щелочное растворение и высвобождая водород, а также образуют соединения с неактивными неметаллами, например, с кислородом при образовании оксидов.
Интересно отметить, что у щелочноземельных металлов электроотрицательность уменьшается с увеличением атомного номера. Бериллий и магний являются наиболее электроотрицательными в этой группе, а радий - наименее электроотрицательный.
Щелочноземельные металлы имеют широкое применение в различных областях, включая производство сплавов, производство стали, производство огнестойких материалов, а также в медицине и в производстве косметических продуктов.
Химические элементы
Химические элементы – это вещества, состоящие из атомов, имеющих одинаковое число протонов в ядре. Они формируют основу всей известной нам материи и могут соединяться друг с другом, образуя химические соединения. Всего на протяжении истории было открыто и исследовано более 100 химических элементов.
Каждый химический элемент обозначается своим символом, состоящим из одной или двух букв латинского алфавита. Некоторые символы были взяты в честь английских или латинских названий элементов, а некоторые были получены от их первоначальных названий на других языках.
Химические элементы располагаются в таблице Менделеева, которая представляет собой систематическую и упорядоченную сетку, где элементы группируются по своим общим свойствам. В таблице Менделеева элементы расположены по возрастанию атомного числа, что позволяет увидеть закономерности в их свойствах и способность элементов образовывать соединения.
У каждого элемента есть свойственное ему атомное число, которое определяет его положение в таблице Менделеева. Атомное число равно числу протонов в ядре атома и определяет его химические свойства. Например, элемент с атомным числом 6 будет углеродом, а с атомным числом 79 – золотом.
Химические элементы могут быть разделены на различные группы по их общим свойствам. Например, щелочные металлы – это элементы из первой группы таблицы Менделеева, которые обладают свойством хорошо растворяться в воде и образовывать щелочные растворы. Щелочноземельные металлы – это элементы из второй группы, которые также обладают химическими свойствами, характерными для металлов.
Химические элементы играют важную роль во многих аспектах нашей жизни. Некоторые из них являются неотъемлемыми компонентами живых организмов, таких как углерод, кислород и водород. Другие элементы используются в промышленности для производства различных материалов, электроники, лекарств и т.д.
Количество электронов на внешнем электронном слое у щелочноземельных металлов

Щелочноземельные металлы — это элементы второй группы периодической системы элементов. Они включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Основным химическим свойством щелочноземельных металлов является наличие двух электронов на внешнем электронном слое.
Такое количество электронов на внешнем слое делает щелочноземельные металлы химически активными. Они стремятся отдать эти два электрона, чтобы достичь стабильной электронной конфигурации. Из-за этой активности щелочноземельные металлы легко реагируют с другими элементами и в форме ионов образуют ионы с положительным зарядом.
Количество электронов на внешнем электронном слое щелочноземельных металлов определяет их химические свойства и способность образовывать соединения. Например, бериллий имеет 2 электрона на внешнем слое, поэтому он легко образует соединения с другими элементами, особенно с кислородом. Кальций, имеющий 2 электрона на внешнем слое, также обладает высокой активностью и часто образует ионы с положительным зарядом.
Количество электронов на внешнем электронном слое щелочноземельных металлов имеет большое значение в различных областях науки и техники. Это свойство позволяет использовать их в различных процессах, таких как производство сплавов, каталитических реакций, электролитов и других важных химических процессах.
Состояние вещества
Щелочноземельные металлы, такие как гелий, бериллий, магний, кальций и другие, встречаются в природе в различных состояниях. В зависимости от условий, эти металлы могут быть как твёрдыми, так и газообразными.
Гелий – самый лёгкий щелочноземельный металл, который в нормальных условиях обычно находится в состоянии газа. Он обладает очень низкой температурой плавления и кипения, и его атомы образуют стабильные двуатомные молекулы.
Бериллий – твёрдый металл, который встречается в природе в виде различных минералов. Он обладает высокой температурой плавления и высокой плотностью. Бериллий является хорошим проводником тепла и электричества.
Магний – блестящий серебристо-белый металл, который также в основном встречается в природе в виде руд. Магний имеет низкую плотность, но при этом является очень прочным. Он обладает отличными свойствами коррозионной стойкости и используется в различных отраслях промышленности.
Кальций – мягкий серебристо-белый металл, который легко реагирует с водой и влажностью. Он образует оксиды и гидроксиды, что делает его хорошим щелочным оксидом. Кальций используется во многих областях, включая строительство, металлургию и медицину.
Таким образом, состояние вещества щелочноземельных металлов зависит от их физических свойств, таких как температура плавления и кипения, плотность, их реакционная способность и другие химические свойства.
Внешний электронный слой
Внешний электронный слой – это слой электронов, который находится на самом внешнем (валентном) энергетическом уровне атома. Этот слой определяет химические свойства элемента, так как электроны на внешнем слое принимают активное участие в химических реакциях. Валентные электроны весьма мобильны и могут участвовать в образовании химических связей.
У щелочноземельных металлов внешний электронный слой содержит два электрона. Щелочноземельные металлы представлены элементами второй группы периодической таблицы, такими как бериллий, магний, кальций, стронций и др. Все они имеют атомарные номера от 4 до 12.
Валентные электроны внешнего слоя щелочноземельных металлов отвечают за их важные свойства, такие как способность образовывать ионные соединения и образование двух валентных состояний: ионное (со степенью окисления +2) и валентное (со степенью окисления +1).
Благодаря наличию всего двух электронов на внешнем энергетическом слое, щелочноземельные металлы обладают высокой активностью, легко вступая в химические реакции. Они способны образовывать соединения с кислородом, водородом, неположительными ионами, аммиаком и другими веществами.
Строение атома
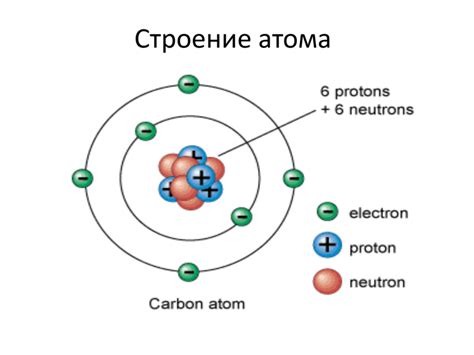
Атом – это наименьшая частица элемента, которая сохраняет его химические свойства. Состоит атом из ядра и электронной оболочки.
Ядро – это положительно заряженная часть атома, в которой находятся протоны и нейтроны. Протоны обладают положительным зарядом, а нейтроны не имеют заряда.
Электронная оболочка – это область, окружающая ядро атома, где находятся электроны. Электроны обладают отрицательным зарядом и движутся по "уровням" или электронным оболочкам. Каждая электронная оболочка может вмещать определенное количество электронов.
На внешней электронной оболочке находятся валинтные электроны, которые принимают участие в химических реакциях и определяют химические свойства элемента.
Распределение электронов

Распределение электронов на внешнем электронном слое у щелочноземельных металлов определяется их положением в периодической таблице Менделеева. Щелочноземельные металлы находятся во второй группе и включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
У каждого атома щелочноземельного металла на внешнем электронном слое находятся два электрона. Это обусловлено тем, что атомы щелочноземельных металлов имеют две электронные оболочки, на первой оболочке находится два электрона, а на второй - остальные электроны. Поэтому на внешнем электронном слое у щелочноземельных металлов всегда два электрона, что делает их химические свойства устойчивыми и позволяет им образовывать ионные связи.
Отличительной особенностью щелочноземельных металлов является то, что они стремятся отдать два электрона на внешнем слое и образовать ион положительного заряда, так как это позволяет им достигнуть стабильного электронного строения, а именно заполнить первую электронную оболочку. Таким образом, щелочноземельные металлы обычно образуют ионы двухвалентного положительного заряда.
Электронная конфигурация
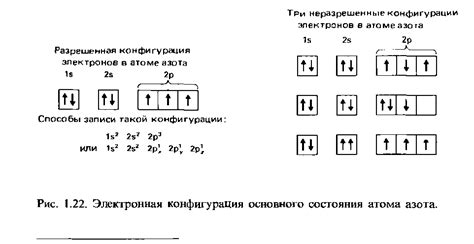
Электронная конфигурация щелочноземельных металлов - это способ представления расположения электронов на энергетических уровнях и подуровнях атома. Она описывает количество электронов на каждом энергетическом уровне и помогает определить количество электронов на внешнем электронном слое.
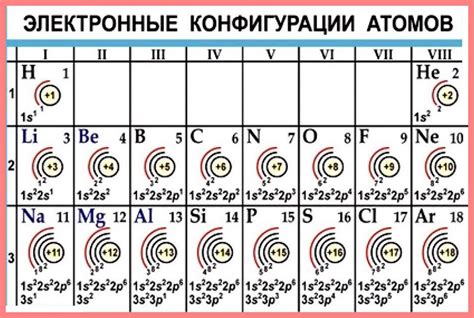
Все щелочноземельные металлы имеют электронную конфигурацию внешнего слоя ns^2, где n - номер энергетического уровня. Неон (Ne) является законченным энергетическим уровнем для последующих элементов.
Например, электронная конфигурация кальция (Ca) имеет вид 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2. Это означает, что кальций имеет 20 электронов, расположенных на четырех различных энергетических уровнях: первый энергетический уровень - 2 электрона, второй - 8 электронов, третий - 8 электронов и четвертый - 2 электрона.
Бериллий (Be), магний (Mg), стронций (Sr) и барий (Ba) также имеют аналогичную электронную конфигурацию на своем внешнем электронном слое, состоящую из двух электронов. Это делает их очень реактивными и способными легко образовывать ионы с положительным зарядом, теряя свои два электрона на внешнем слое.
Вопрос-ответ

Сколько электронов на внешнем электронном слое у щелочноземельных металлов?
У щелочноземельных металлов на внешнем электронном слое обычно находится 2 электрона.
Почему у щелочноземельных металлов на внешнем электронном слое 2 электрона?
Количество электронов на внешнем электронном слое щелочноземельных металлов равно 2, так как они находятся во второй группе периодической таблицы и имеют два электрона в s-орбитали на этом слое.
