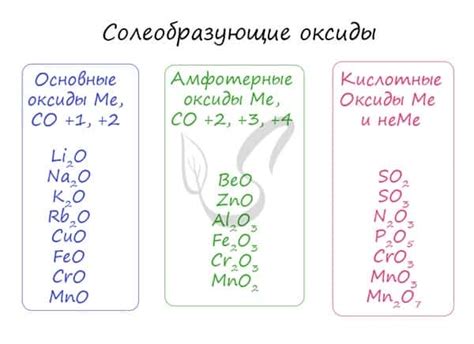
Металлы щелочные амфотерные – это группа элементов периодической системы, которая включает в себя такие химические элементы как алюминий, олово, цинк, свинец и др. Они относятся к металлам, которые обладают свойствами щелочных металлов и амфотерности.
Щелочные металлы отличаются высокой реакционной способностью и активностью в контакте с кислородом и водой. Они имеют низкую электроотрицательность и тем самым способны легко отдавать электроны в химических реакциях. Свойства щелочных металлов также включают низкую температуру плавления и кипения, а также светящийся пламя при горении.
Амфотерные металлы являются металлами, которые обладают как щелочными, так и кислотными свойствами. Они способны реагировать с кислотами и основаниями, проявляя себя как кислоты или основания в зависимости от условий. Им свойственна способность образовывать соли и гидроксиды, а также растворяться в кислотных и основных средах.
Отличия металлов щелочные амфотерные
Металлы щелочные и амфотерные представляют собой разные классы металлов, отличающиеся своими химическими свойствами и реакционной способностью. Вот несколько основных отличий между этими двумя классами металлов:
Уровень реакционной способности: Металлы щелочные находятся на более активном уровне реакционной способности, чем металлы амфотерные. Это означает, что металлы щелочные более легко вступают в химические реакции с другими веществами, включая воду и кислород.
Отношение к воде: Металлы щелочные реагируют с водой, образуя щелочные растворы. Металлы амфотерные могут реагировать как с щелочами, так и с кислотами, образуя соли и воду.
Электронная конфигурация: Металлы щелочные обладают одной валентной электронной оболочкой, что делает их более реакционноспособными. Металлы амфотерные имеют несколько электронных оболочек, что даёт им большую стабильность и меньшую реакционную способность.
Физические свойства: Металлы щелочные обладают мягкостью, низкой плотностью и низкой температурой плавления по сравнению с металлами амфотерными. Металлы амфотерные, в свою очередь, обычно являются более твёрдыми и имеют более высокую плотность.
Все эти отличия делают металлы щелочные и амфотерные важными и полезными для различных применений в химической промышленности и других отраслях. Понимание этих характеристик помогает определить их свойства и использовать их соответствующим образом.
Щелочные металлы
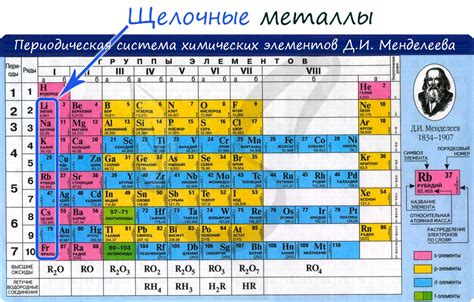
Щелочные металлы - это группа химических элементов в периодической таблице, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе элементов и характеризуются своими химическими свойствами и реактивностью.
Самым легким и наиболее распространенным щелочным металлом является натрий. Он активно реагирует с кислородом, водой и другими веществами, образуя соли и гидроксиды. Калий также обладает подобными свойствами и широко используется в различных отраслях промышленности.
Щелочные металлы обладают низкой плотностью и низкой температурой плавления, что делает их хорошими материалами для производства легких конструкций. Они также являются хорошими проводниками электричества и имеют высокую электропроводность.
Важной особенностью щелочных металлов является их способность образовывать ионы с положительным зарядом. Заряд этих ионов равен +1. Это делает щелочные металлы активными элементами при взаимодействии с другими веществами.
- Литий является наименее реактивным из щелочных металлов и часто используется в батареях.
- Натрий является широко используемым элементом в пищевой промышленности и в производстве стекла.
- Калий используется в удобрениях, взрывчатых веществах и в производстве полимеров.
- Рубидий используется в научных исследованиях и в производстве оптических приборов.
- Цезий применяется в атомных часах и в электронике.
- Франций является самым редким и самым тяжелым щелочным металлом. Его изотопы имеют короткое время жизни и встречаются в крайне малых количествах в земной коре.
У всех щелочных металлов есть общая химическая формула MO, где M - щелочной металл, а O - кислород. Они реагируют с кислородом, образуя оксиды, которые являются основаниями.
Амфотерные металлы
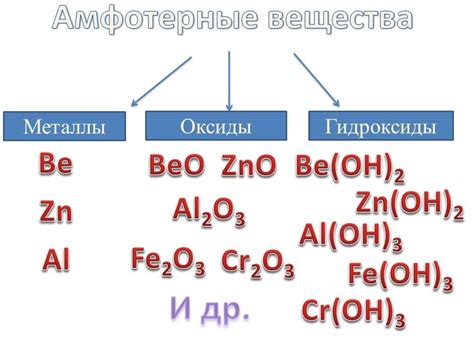
Амфотерные металлы – это класс металлов, которые могут образовывать ионы как с положительными, так и с отрицательными зарядами в растворах.
Амфотерные металлы проявляют амфотерные свойства, то есть они могут проявлять и кислотные, и основные свойства в различных условиях.
К ним относятся такие металлы, как алюминий, свинец, цинк, железо, медь и некоторые другие.
Амфотерные свойства металлов обусловлены их электронной структурой и наличием свободных электронов во внешних энергетических оболочках.
Одним из примеров является амфотерность алюминия. Он может реагировать как с кислотами (образуя алюминатные ионы), так и с основаниями (образуя гидроксид алюминия).
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы - это группа элементов периодической таблицы, которые относятся к первой группе и включают литий, натрий, калий, рубидий, цезий и франций. Они получили название "щелочные" из-за своей реактивности с водой, в результате которой образуется щелочное растворение.
Что такое амфотерные металлы?
Амфотерные металлы - это элементы периодической таблицы, которые могут проявлять и кислотные, и основные свойства в химических реакциях. Они могут реагировать и с кислотами, и с основаниями, образуя соли.
Как происходит классификация металлов?
Классификация металлов происходит на основе их свойств и химической активности. Металлы могут быть классифицированы по разным признакам, таким как металлический блеск, теплопроводность, электропроводность и химическая активность. Щелочные металлы и амфотерные металлы являются двумя такими категориями.
Какие элементы относятся к группе щелочных металлов?
К группе щелочных металлов относятся литий, натрий, калий, рубидий, цезий и франций. Они находятся в первой группе периодической таблицы и имеют общую химическую активность, реагируя с водой и кислородом.
