Разделение металлов по степени активности - важная задача в химии и металлургии. Она позволяет определить, какой металл будет реагировать с другими веществами. Поэтому металлы классифицируются на основе их химической активности.
Одной из основных классификаций является деление на активные и инертные металлы. Активные металлы обладают высокой химической активностью, они легко вступают в реакцию с кислородом, водородом и другими веществами. К инертным металлам относятся те, которые практически не реагируют с другими веществами.
Вторая классификация основана на ряде металлов. Это так называемый ряд активностей металлов по отношению к водороду. По этому ряду металлы делятся на две группы: активные и неактивные. Активные металлы находятся в верхней части ряда и обладают высокой химической активностью. Неактивные металлы, находящиеся в нижней части ряда, имеют более низкую активность и могут быть использованы в различных промышленных процессах.
Степень активности металлов: понятие и значение

Степень активности металлов - это характеристика, определяющая способность металла взаимодействовать с окружающей средой. Эта характеристика имеет важное значение в различных областях, таких как металлургия, химия, электроэнергетика и другие.
Основные свойства металлов, определяющие их степень активности, это электрохимический потенциал и скорость реакций с кислородом, водой и кислотами. Наиболее активными металлами являются щелочные и щелочноземельные металлы, такие как натрий, калий и кальций, которые очень быстро окисляются на воздухе и растворяются в воде и кислотах.
Степень активности металлов имеет важное практическое значение, поскольку она определяет их возможности использования в различных технических процессах. Например, металлы с высокой степенью активности, такие как алюминий и магний, широко применяются в аэрокосмической и автомобильной промышленности благодаря своей легкости и прочности. С другой стороны, металлы с низкой степенью активности, такие как золото и платина, используются в ювелирном деле и электронике из-за своей стойкости к окислению и коррозии.
Металлы: активность и реактивность

Металлы являются одной из основных групп элементов в периодической системе химических элементов. Они обладают высокой теплопроводностью и электропроводностью, а также обладают светоотражающими свойствами. Одной из важных характеристик металлов является их активность или способность реагировать с другими веществами.
Активность металлов зависит от их электрохимического потенциала, который указывает на их способность отдавать или получать электроны. Чем выше электрохимический потенциал, тем более активным является металл. Наиболее активные металлы, такие как литий и калий, способны реагировать с кислородом из воздуха или водой, что приводит к их быстрому окислению.
Металлы обладают также реактивностью, которая определяется их способностью взаимодействовать с другими элементами и соединениями. В зависимости от химического окружения и свойств металла, его реактивность может быть различной. Некоторые металлы, такие как золото и платина, отличаются низкой реактивностью и химической инертностью, что делает их ценными материалами для ювелирных изделий и электронных компонентов.
Однако, необходимо отметить, что активность и реактивность металлов не являются исключительно отрицательными характеристиками. Напротив, они обеспечивают металлам широкий спектр применений в различных отраслях промышленности и науки, от производства структурных материалов до использования в электрохимических процессах и катализе.
Основные способы классификации металлов по активности

Металлы могут быть разделены по степени активности на основе нескольких способов. Основной метод классификации - это ряд термодинамической (электрохимической) активности металлов. Этот ряд основан на потенциалах полуволнового окисления металлов и помогает определить их способность к реакциям окисления и восстановления.
Наиболее распространенным и широко используемым способом классификации является ряд активности металлов по возрастанию. Он включает металлы от самых активных до наименее активных. Самыми активными металлами являются щелочные и щелочноземельные металлы, такие как литий, натрий, калий, магний и кальций. Наименее активными металлами являются платина, золото и серебро.
Другим способом классификации является ряд напряжений окислительно-восстановительных пар. Этот ряд описывает электрохимическую активность металлов и их способность к реакциям окисления и восстановления. Чем больше разница в потенциалах окисления и восстановления, тем более активными металлами являются элементы.
Кроме того, металлы могут быть классифицированы по их способности образовывать ионы или соединяться с другими веществами. Например, щелочные металлы образуют ионы, легко реагируют с водой и образуют щелочные растворы. С другой стороны, некоторые металлы, такие как платина, обладают низкой способностью образования ионов и образовывают стабильные соединения.
В целом, классификация металлов по активности имеет важное значение для понимания их химических и физических свойств, и она широко используется в научных и промышленных целях, а также в образовательных процессах.
Классификация металлов по электрохимическому потенциалу
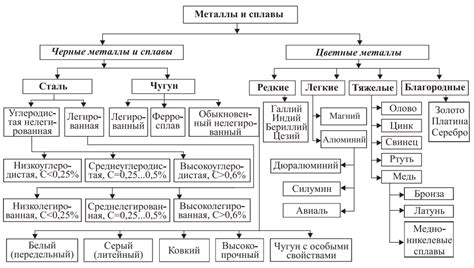
Классификация металлов по электрохимическому потенциалу является одним из способов разделения металлов в зависимости от их активности в химических реакциях. Электрохимический потенциал металла рассчитывается по стандартной таблице стандартных потенциалов, где относительное положение металлов по электрохимическому потенциалу определено относительно водорода.
На основе электрохимического потенциала металлы можно разделить на несколько классов. Наиболее активные металлы в химических реакциях имеют отрицательное значение электрохимического потенциала. К ним относятся, например, щелочные металлы, такие как литий, натрий и калий. Они легко образуют ионы в растворах и реагируют с кислородом в воде или влажном воздухе.
Следующий класс металлов - это металлы, которые не реагируют с кислородом и образуют инертные оксиды. Они имеют положительное, но не очень высокое значение электрохимического потенциала. К этому классу относятся такие металлы, как алюминий, магний и цинк. Они обладают хорошей коррозионной стойкостью и применяются в различных отраслях промышленности.
Наименее активные металлы имеют самое высокое положительное значение электрохимического потенциала. К ним относятся такие металлы, как золото, платина и серебро. Они обладают высокой устойчивостью к коррозии и часто используются в ювелирной промышленности.
Классификация металлов по электрохимическому потенциалу важна для определения их применения и свойств при контакте с другими материалами и средой. Это также позволяет разработать протоколы для защиты металлов от коррозии и повреждений.
Классификация металлов по реактивности с воздухом
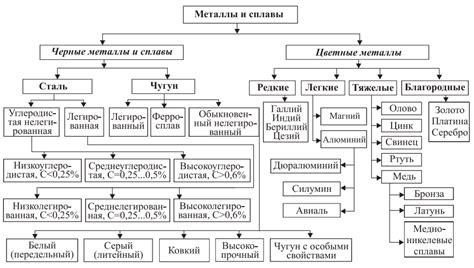
В зависимости от их реактивности с воздухом, металлы можно классифицировать на несколько групп. Эта классификация основана на том, какие реакции возникают между металлами и кислородом воздуха.
Первая группа включает металлы, которые не реагируют с кислородом воздуха или реагируют очень медленно. К ним относятся золото и платина. Эти металлы обладают высокой химической инертностью и не окисляются на воздухе.
Вторая группа металлов включает металлы, которые реагируют с кислородом воздуха при нагревании. К ним относятся железо, никель и алюминий. При взаимодействии с кислородом они образуют оксиды металлов.
Третья группа металлов включает металлы, которые реагируют с кислородом воздуха уже при обычных температурах. К ним относятся такие металлы, как натрий, калий и магний. Реакция этих металлов с кислородом воздуха приводит к образованию оксидов и ещё более сложных химических соединений.
Классификацию металлов по реактивности с воздухом можно использовать для определения способа хранения и обработки металлических изделий, а также выбора подходящих материалов для различных технических задач.
Классификация металлов по реактивности с кислотами
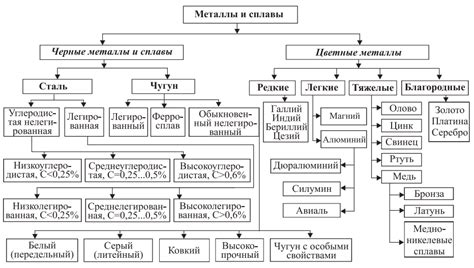
Металлы могут проявлять различные степени реактивности при взаимодействии с кислотами. Зависимость этой реактивности от электрохимической активности металла позволяет провести классификацию металлов по их взаимодействию с кислотами.
Самые активные металлы, такие как литий, натрий и калий, проявляются довольно агрессивно при контакте с кислотами. С ними происходят интенсивные химические реакции, сопровождающиеся выделением газа и высокой температурой.
Менее активные металлы, например, магний, алюминий и цинк, также реагируют с кислотами, но не так интенсивно. Реакции их сопровождаются выделением газа, но температура при этом не так высока.
Наиболее пассивные металлы, такие как железо, медь и свинец, образуют слабые реакции с кислотами. Обычно реакции этих металлов не сопровождаются выделением газа и происходят при комнатной температуре без значительного повышения температуры.
Таким образом, классификация металлов по реактивности с кислотами позволяет определить их способность проявлять активность и степень интенсивности реакций при взаимодействии с кислотами. Эта классификация имеет важное практическое значение для выбора материалов в различных отраслях промышленности и лабораторных исследованиях.
Вопрос-ответ

Для чего нужно разделять металлы по степени активности?
Разделение металлов по степени активности нужно для определения их способности взаимодействовать с другими веществами. Это позволяет более эффективно использовать металлы в различных процессах и химических реакциях.
Какие основные классификации разделения металлов по степени активности существуют?
Существует несколько основных классификаций разделения металлов по степени активности. Наиболее распространенная классификация основана на серии активности металлов, где каждый металл занимает определенное место в списке в зависимости от своей активности. Также металлы могут быть разделены по своей реакционной способности на основные и побочные металлы, или по их способности образовывать соединения с кислородом на активные и пассивные металлы.
Как определяется степень активности металлов в серии активности?
Степень активности металлов в серии активности определяется их способностью вступать в реакцию с водородом или в водной среде. Металлы, занимающие высокие места в серии активности, более активны и легко взаимодействуют с водородом или водой, тогда как металлы, занимающие низкие места, менее активны и медленнее реагируют.
