Одним из важных процессов в химии является взаимодействие кислоты и оксида металла, сопровождающееся образованием солей. Кислоты и оксиды металлов представляют собой различные классы химических соединений, обладающих уникальными свойствами и активностью.
В результате взаимодействия кислоты с оксидом металла происходит образование солей, которые характеризуются определенными свойствами, такими как растворимость, кристаллическая структура, цветность и т.д.
Интересующая нас реакция происходит путем соединения атомов металла из оксида с отрицательными ионами водорода из кислоты, что приводит к образованию ионной решетки соли. В ходе реакции происходит выделение тепла и поглощение или выделение газов.
Образование солей при взаимодействии кислоты и оксида металла является важной химической реакцией, которая находит применение во многих областях, включая промышленность, аграрный сектор и медицину. Знание принципов данной реакции позволяет эффективно использовать ее для получения нужных веществ и разработки новых материалов.
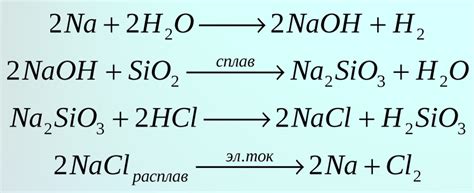
Процесс образования солей

Соли - это химические соединения, состоящие из катионов и анионов. Известно множество различных способов образования солей, одним из которых является реакция между кислотой и оксидом металла.
Во время реакции между кислотой и оксидом металла происходит образование соли и воды. Кислота отдает водородные ионы (H+) аниону оксида металла, что приводит к образованию соли. Например, реакция между соляной кислотой (HCl) и оксидом натрия (Na2O) приводит к образованию хлорида натрия (NaCl) и воды:
2HCl + Na2O → 2NaCl + H2O
В процессе образования солей также могут участвовать оксианоины, такие как карбонаты и гидроксиды. Например, реакция между серной кислотой (H2SO4) и гидроксидом натрия (NaOH) приводит к образованию сульфата натрия (Na2SO4) и воды:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
В некоторых случаях образование солей может сопровождаться выделением газа. Например, реакция между соляной кислотой (HCl) и оксидом железа (III) (Fe2O3) приводит к образованию хлорида железа (III) (FeCl3), воды и выделению газообразного оксида углерода (CO2):
6HCl + Fe2O3 → 2FeCl3 + 3H2O + 3CO2
Образование солей при взаимодействии кислоты и оксида металла - это только один из способов образования солей, который широко применяется в химической промышленности и имеет большое значение в химических процессах и реакциях.
Определение солей

Соли — это химические соединения, которые возникают при взаимодействии кислоты с основанием. Они представляют собой результат реакции, при которой металл из оксида металла или гидроксида реагирует с кислотой, замещая водород. Образующиеся при этом соли содержат катион металла и анион кислоты.
Определение солей осуществляется с помощью различных химических методов. Первым шагом в анализе солей является их разложение. Для этого соль пропускают через плавиковую или кленовую щепку, при этом выделяется специфический запах. Далее проводят реакции с различными реагентами, которые позволяют идентифицировать как катион, так и анион соли.
Определение катиона производится различными способами. Например, используют такие реагенты, как сернокислый барий, селитровокислый серебро, сернокислый свинец и другие. В результате взаимодействия реагентов с образцом соли образуются осадки или окрашенные соединения, которые позволяют установить наличие и типов катионов в растворе. Для определения анионов соли используют соответствующие реагенты, например, растворы нитрата серебра, хлорида бария и др.
Определение солей имеет большое значение в химии и аналитической химии. Оно позволяет исследовать структуру и свойства соединений, а также использовать соли в различных областях науки и промышленности, например, в медицине, сельском хозяйстве, производстве удобрений, косметике и других отраслях.
Химические уравнения
Химическое уравнение - это способ записи химической реакции с помощью символов и формул химических веществ. Оно позволяет изобразить процесс взаимодействия веществ, а также отразить количество веществ, участвующих в реакции.
Химическое уравнение состоит из двух частей: реагентов (веществ, которые участвуют в реакции) и продуктов (веществ, образующихся в результате реакции). Между реагентами и продуктами ставят знак равенства.
В химическом уравнении важно соблюдать закон сохранения массы и заряда. Это значит, что количество атомов каждого элемента до и после реакции должно оставаться неизменным, а сумма зарядов должна быть сбалансирована.
Для более удобной записи химических уравнений, используются коэффициенты, которые указывают количество молекул или ионов каждого вещества, участвующего в реакции. Они помогают сбалансировать уравнение и обеспечить соблюдение законов сохранения.
Например, химическое уравнение для реакции образования соли между кислотой и оксидом металла может выглядеть следующим образом:
HCl + CrO3 → H2CrO4
В данном случае кислота взаимодействует с оксидом хрома, образуя хромовую кислоту. Запись химического уравнения позволяет визуально представить реакцию и указать, какие вещества участвуют в процессе и что образуется в результате.
Взаимодействие кислоты и оксида металла
Взаимодействие кислоты и оксида металла является основным процессом образования солей. Когда кислота и оксид металла соприкасаются, происходит химическая реакция, в результате которой образуются соли и вода.
Процесс взаимодействия кислоты и оксида металла может быть представлен уравнением реакции:
Кислота + Оксид металла → Соль + Вода
Взаимодействие кислоты и оксида металла основано на том, что кислоты содержат ионы водорода (H+), которые способны замещать металл в оксиде, образуя ионные связи с отрицательно заряженными ионами оксида. Таким образом, металл из оксида переходит в соль, а водородные ионы из кислоты образуют молекулы воды.
Взаимодействие кислоты и оксида металла является основой для процессов образования различных солей. Например, при взаимодействии серной кислоты с оксидом натрия образуется соль натрия (Na2SO4) и вода:
H2SO4 + Na2O → Na2SO4 + H2O
Такие реакции широко используются в химической промышленности для получения разных видов солей, которые находят применение в многих отраслях науки и техники.
Реактивность оксидов металлов
Реактивность оксидов металлов является одним из ключевых параметров, определяющих их способность взаимодействовать с кислотами и образовывать соли. Различные оксиды металлов могут проявлять разную степень реактивности, что обусловлено их химическим составом и структурой.
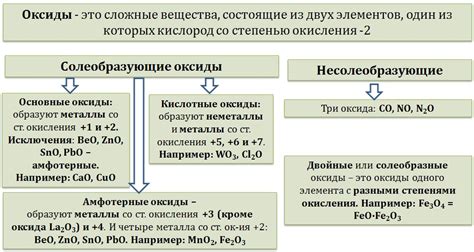
Оксиды металлов могут быть разделены на кислотные и основные в зависимости от своей реакции с кислотами. Кислотные оксиды проявляют кислотные свойства и образуют соли, взаимодействуя с основаниями или щелочами. Они способны давать растворимые соли или кислотные растворы, так как образующиеся соли обычно растворимы в воде. Примерами кислотных оксидов могут служить оксид серы (SO₂), оксид азота (NO₂) и оксид углерода (CO₂).
Основные оксиды, напротив, образуют основания, взаимодействуя с кислотами. Они обычно нерастворимы в воде и могут быть получены только путем специальных химических реакций. Основные оксиды также могут использоваться для нейтрализации кислот в различных процессах, таких как очистка воды или обработка отходов. Примерами основных оксидов могут служить оксид кальция (CaO), оксид натрия (Na₂O) и оксид алюминия (Al₂O₃).
Реактивность оксидов металлов может быть связана с их положением в ряду активности металлов. Обычно более активные металлы формируют более реактивные оксиды. Однако, существуют исключения, и некоторые металлы могут образовывать оксиды с неожиданной степенью реактивности. Например, оксид железа (III) (Fe₂O₃) показывает высокую реактивность, несмотря на то, что железо является довольно устойчивым металлом.
Практическое применение солей

Соли, получаемые при взаимодействии кислоты и оксида металла, находят широкое практическое применение в различных отраслях науки и промышленности.
Одним из основных областей применения солей является медицина. Некоторые соли, такие как сульфат магния и хлорид натрия, применяются в медицине для проведения процедур, таких как инъекции и инфузии. Они используются для восполнения потери электролитов в организме, регулирования кислотно-щелочного баланса, а также для лечения различных заболеваний и состояний.
Соли также используются в пищевой промышленности, в основном в качестве добавок в пищевых продуктах. Они могут использоваться для придания определенного вкуса, улучшения консистенции или сохранения свежести продукта. Например, соль натрия может использоваться как консервант для мяса и рыбы.
Многие соли имеют широкое применение в процессе производства стекла и керамики. Например, оксид кальция (известь) используется для придания стеклу прозрачности и прочности, оксид кобальта применяется для получения синей керамики, а оксид железа дает красный оттенок.
Соли также находят применение в химической промышленности и аналитической химии. Они могут быть использованы в качестве ионных проводников, катализаторов, компонентов электролитов и многих других процессов.
Таким образом, практическое применение солей, получаемых при взаимодействии кислоты и оксида металла, охватывает различные отрасли науки и промышленности, от медицины и пищевой промышленности до производства стекла и химической промышленности.
Вопрос-ответ

Какие соли образуются при взаимодействии кислоты и оксида металла?
При взаимодействии кислоты и оксида металла образуются соли, которые состоят из металлического катиона и аниона, образованного от кислоты. Например, при взаимодействии серной кислоты (H2SO4) и оксида натрия (Na2O) образуется соль натрия, то есть сульфат натрия (Na2SO4).
Почему при взаимодействии кислоты и оксида металла образуются соли?
При взаимодействии кислоты и оксида металла происходит химическая реакция, в результате которой образуется соль. Кислота передает свой протон (водородный ион) оксиду, который действует как основание и принимает данный протон. Таким образом, образуется соль, состоящая из металлического иона и аниона, образованного от кислоты.
Можно ли использовать любую кислоту и любой оксид металла для образования соли?
Нет, для образования соли не любая кислота и оксид металла подойдут. Чтобы произошла реакция и образовалась соль, кислота и оксид металла должны быть химически активными. Также необходимо, чтобы кислота и оксид металла имели совместимость по ионным радиусам, чтобы ионы могли образовать устойчивую решетку в соли.
Какие еще продукты могут образоваться при взаимодействии кислоты и оксида металла, кроме соли?
При взаимодействии кислоты и оксида металла кроме соли могут образоваться и другие продукты. Например, может образоваться вода, если кислота и оксид металла содержат водород и кислород соответственно. Также может образоваться газ, если одним из продуктов реакции является газообразное соединение, например, оксид углерода или диоксид углерода.
Может ли взаимодействие кислоты и оксида металла протекать без образования соли?
Да, взаимодействие кислоты и оксида металла может протекать и без образования соли. Например, это возможно, если кислота и оксид металла не реагируют между собой, а лишь совместно действуют на другие вещества в реакционной среде. В этом случае могут образоваться другие продукты, например, вода или газ.
