Свойства кислот и оснований являются основными понятиями химии и играют важную роль в химических реакциях. Кислоты и основания могут вступать во взаимодействие с различными веществами, но не проявляют активности по отношению к солям металлов и оксидам неметаллов.
Кислоты - вещества со способностью отдавать протоны, образуя положительные ионы. Основания, наоборот, могут принимать протоны и образовывать отрицательные ионы. Однако, кислоты и основания не реагируют с солями металлов и оксидами неметаллов. Это обусловлено специфическими свойствами этих соединений.
Соли металлов образуются в результате реакций кислот с основаниями. Они состоят из положительных (металлических) ионов и отрицательных (кислотных) ионов. Основания и соли металлов имеют различную структуру и не взаимодействуют между собой.
Оксиды неметаллов также не вступают в реакции с кислотами и основаниями. Они являются активными по отношению к воде и образуют кислоты или основания в зависимости от своей природы. Таким образом, свойства кислот и оснований проявляются только в реакциях с веществами, способными принимать или отдавать протоны.
В заключение, свойства кислот и оснований определяются их способностью принимать или отдавать протоны. Они не проявляют активности по отношению к солям металлов и оксидам неметаллов, поскольку это реактивные вещества и вступают во взаимодействие только с определенными группами соединений.
Свойства кислот и оснований

Кислоты - это вещества, которые отделяют положительный водород (H+) и ион аниона соотношение 1: n, когда растворяются в воде. Они обычно имеют кислый вкус и образуют соли с металлами и основаниями. Кислоты обладают pH ниже 7 и могут реагировать с металлами, оксидами неметаллов и основаниями.
Основания, напротив, являются веществами, которые отделяют отрицательный гидроксильный ион (OH-) и положительный катион соотношение 1: n, когда они растворяются в воде. Они имеют горький вкус и творят соли с кислотами. Основания обладают pH выше 7 и могут реагировать с кислотами и солями металлов.
Некоторые химические реакции, в которых участвуют кислоты и основания:
- Реакция нейтрализации: когда кислота и основание реагируют в равных количествах, образуется соль и вода. Например, HCl + NaOH → NaCl + H2O;
- Реакция образования соли: когда кислота реагирует с металлом или его оксидом, образуется соль. Например, HCl + Mg(OH)2 → MgCl2 + H2O;
- Реакция диссоциации: когда кислота или основание разлагается на ионы в растворе. Например, HCl → H+ + Cl-;
- Реакция гидролиза: когда соль разлагается на кислоту и основание при контакте с водой. Например, NaCl + H2O → HCl + NaOH.
Свойства кислот и оснований полезно знать во многих областях, включая химию, медицину и пищевую промышленность. Понимание их свойств позволяет предсказывать химические реакции и использовать их в различных процессах и приложениях.
Невзаимодействие с солями металлов

Одной из особенностей кислот и оснований является их невзаимодействие с солями металлов. Соли металлов представляют собой соединения металлов с кислотами, их основным свойством является образование ионов металла в растворе. Кислоты, напротив, характеризуются способностью отдавать протоны, а основания – принимать их.
Именно из-за этих различий нет взаимодействия между солями металлов и кислотами или основаниями. Например, соль натрия (NaCl) и кислота соляная (HCl) не реагируют друг с другом, так как их ионы не могут осуществлять обмен протонами. Аналогично, соли металлов не реагируют с основаниями, такими как натриевая гидроксидная (NaOH) или аммиак (NH3).
Это свойство обусловлено различием в строении ионов веществ. Чтобы образовалась реакция, необходимо, чтобы ионизованные части вещества могли образовывать связи или обновить уже существующие связи в результате обмена протонами. В случае с солями металлов, металлический ион и ион кислоты уже находятся в связи друг с другом и не могут образовать новые связи с протонами.
Таким образом, невзаимодействие с солями металлов является одним из ключевых свойств кислот и оснований, что отличает их от других классов химических веществ.
Оксиды неметаллов и кислоты
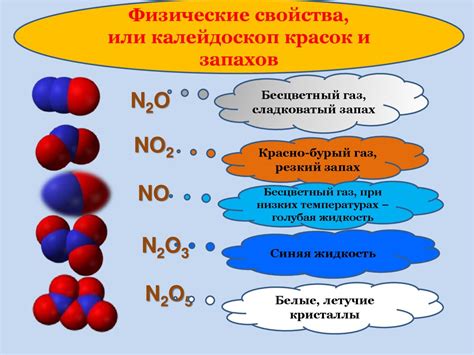
Оксиды неметаллов являются основной группой веществ, которые могут взаимодействовать с кислотами. Кислоты и оксиды неметаллов обладают сходными свойствами и способностью образовывать химические реакции при контакте друг с другом.
Кислоты, известные своей кислотностью, содержат в своей структуре гидроксильную группу, способную отдавать протоны при реакции. Оксиды неметаллов, напротив, являются основными соединениями и обладают свойством приемничества протонов.
Реакция взаимодействия оксидов неметаллов и кислот происходит с образованием соли и воды. В ходе реакции гидроксильная группа в кислоте отдает протон оксиду неметалла, который принимает его и образует молекулу воды. В результате этой реакции образуется соль, которая в общем случае представлена ионами металла и неметалла. Например, взаимодействие оксида углерода(IV) с серной кислотой приводит к образованию соли серы и угольной кислоты:
CO2 + H2SO4 = SO4 + H2CO3
Следует отметить, что в реакциях взаимодействия оксидов неметаллов с кислотами реагенты реагируют в определенном соотношении, обусловленном их валентностями. В итоге образуется стабильное соединение - соль, которое может быть далее использовано в различных отраслях промышленности.
Свойства кислот и оксидов
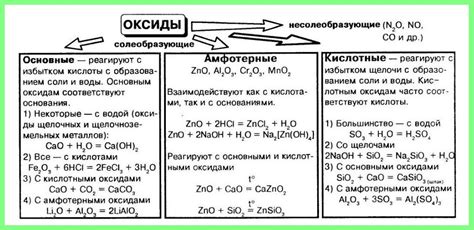
Кислоты и оксиды - это химические соединения, которые обладают различными свойствами и используются в разных сферах науки и промышленности. Кислоты характеризуются кислотной реакцией, способностью отдавать протоны, а оксиды - свойствами окислителей и оснований.
Кислоты образуют ионы водорода в растворе, что придает им характерную кислотность. Они могут реагировать с основаниями, веществами, способными восстанавливать потерянный протон. Кислоты в природе распространены в виде органических и неорганических соединений.
Оксиды, в свою очередь, являются соединениями, состоящими из кислорода и другого элемента. Они проявляют свойства окислителей, так как обладают способностью принимать электроны от других веществ. Некоторые оксиды являются также основаниями, так как могут отдавать гидроксидные ионы в воде.
Свойства кислот и оксидов могут быть использованы во многих областях, включая химическое производство, медицину, пищевую промышленность и технологии. Изучение их свойств и реакций позволяет улучшать процессы и создавать новые материалы и вещества.
Не взаимодействие оснований и солей

Основания и соли - это два разных типа химических соединений, которые обладают различными свойствами и способностью к взаимодействию с другими веществами. В отличие от кислот, основания не образуют солями реакции взаимодействия. Основания реагируют с кислотами, образуя соли и воду. Но при контакте с солями металлов или оксидами неметаллов, основания не вступают в реакцию.
Основания характеризуются высоким уровнем pH, они обладают щелочными свойствами и способностью нейтрализовать кислоты. Соли же представляют собой неорганические соединения, состоящие из ионов металла и кислотного остатка. Как правило, соли имеют нейтральный или слабощелочной характер, но не проявляют свойств оснований.
Соли металлов, такие как хлориды, сульфаты, нитраты и др., имеют разнообразные применения в промышленности, медицине и других сферах. Они не вступают в реакцию с основаниями, поэтому могут быть использованы вместе для получения новых соединений или для изменения pH среды.
Аналогично солям металлов, оксиды неметаллов не взаимодействуют с основаниями. Оксиды неметаллов выполняют роль кислотных оксидов, формируя с кислородом молекулы кислот и создавая кислотные соединения. Эти оксиды не реагируют с основаниями, и их можно использовать вместе для получения новых соединений или использовать в различных химических процессах.
Вопрос-ответ

Какие свойства имеют кислоты?
Кислоты - вещества, обладающие кислотными свойствами, то есть способностью отдавать протоны или протонные ионы при реакции с основаниями или металлами.
Чем отличаются кислоты от оснований?
Кислоты и основания - это взаимообратные понятия, причем с точки зрения свойств. Кислоты отдают протоны или протонные ионы, а основания принимают их. Таким образом, различие между ними заключается в направлении реакции.
