Металлические оксиды являются одними из наиболее распространенных соединений, которые образуются при взаимодействии металлов с кислородом. Оксиды имеют сложную структуру и обладают разными химическими свойствами. Одним из вопросов, которые часто возникают, является то, являются ли металлические оксиды кислотными?
Для ответа на этот вопрос необходимо разобраться в определении кислот и их свойствах. Кислоты – это вещества, которые образуются при реакции между кислотами и основаниями. Кислотность определяется наличием в молекуле водородных ионов, которые обладают положительным зарядом. Однако металлические оксиды не содержат водородных ионов и, следовательно, не могут быть названы кислотами.
Тем не менее, металлические оксиды обладают другими химическими свойствами. Например, они могут реагировать с водой, образуя основания. Это связано с тем, что металлы в оксидах обладают способностью выделять гидроксидные ионы. Из-за этого свойства металлические оксиды иногда называют оксидами оснований или основными оксидами.
Таким образом, можно констатировать, что металлические оксиды не являются кислотными веществами. Они играют важную роль в химии и имеют свои уникальные свойства, такие как способность образовывать основания при реакции с водой.
Влияние металлических оксидов на кислотность
Металлические оксиды - это химические соединения, состоящие из атомов металла и кислорода. Оксиды являются одними из основных классов неорганических соединений.
Многие металлические оксиды обладают определенной степенью кислотности. Кислотность оксида определяется наличием в его составе атомов, способных отдавать протоны. Оксиды металлов, которые могут образовывать кислоты, часто называются амфотерными оксидами.
Амфотерные оксиды проявляют свойства как оснований, так и кислот, то есть они могут реагировать как с щелочами, так и с кислотами. Например, алюминиевый оксид (Al2O3) реагирует с щелочами, образуя соли, а сильные кислоты реагируют с ним, образуя алюминиевые соли.
Однако не все металлические оксиды обладают кислотными свойствами. Некоторые оксиды металлов могут быть неактивными и не реагировать ни с щелочами, ни с кислотами. Например, оксид натрия (Na2O) является щелочным оксидом, так как образует щелочные растворы, но не реагирует с кислотами.
В зависимости от сочетания металла с кислородом и другими элементами, металлические оксиды могут иметь различные степени кислотности. Это свойство является важным при изучении химических реакций и применении оксидов в различных отраслях промышленности и научных исследований.
Оксиды различных металлов и их свойства
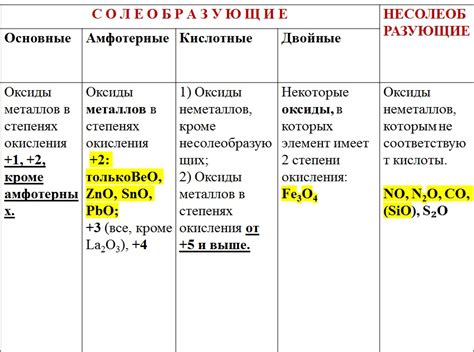
Оксиды металлов - это химические соединения, состоящие из металла и кислорода. Они обладают различными свойствами, в зависимости от металла, к которому принадлежат. Оксиды металлов могут быть как кислотными, так и основными.
Некоторые оксиды металлов являются кислотными соединениями, они образуются, когда металлы вступают в реакцию с кислородом. Примерами таких кислотных оксидов являются оксид серы, оксид азота и оксид углерода. Когда эти соединения растворяются в воде, они образуют кислотные растворы.
Некоторые оксиды металлов, напротив, являются основными соединениями. Они образуются при реакции металлов с кислородом. Примерами таких основных оксидов являются оксид кальция, оксид натрия и оксид магния. Когда эти соединения растворяются в воде, они образуют щелочные растворы.
Также существуют оксиды металлов, которые нейтральны и не образуют ни кислотные, ни основные растворы. Эти соединения называются нейтральными оксидами и могут быть использованы в различных областях, например, в качестве катализаторов или в производстве керамики.
В таблице ниже приведены примеры оксидов различных металлов и их характеристики:
| Металл | Оксид | Свойства |
|---|---|---|
| Алюминий | Оксид алюминия | Нейтральный оксид |
| Железо | Оксид железа | Кислотный оксид |
| Медь | Оксид меди | Основный оксид |
Оксиды металлов играют важную роль в различных отраслях промышленности и науке. Изучение их свойств позволяет понять химические процессы, происходящие в природе и применять их в практических целях.
Металлические оксиды и рН-среда

Металлические оксиды - это химические соединения, состоящие из металлического элемента и кислорода. Когда металл связывается с кислородом, образуется оксид. Эти соединения обладают различными свойствами, в том числе и относительно рН-среды.
РН-среда - это мера концентрации ионов водорода (кислотности) или гидроксид-ионов (щелочности) в растворе. РН-шкала имеет диапазон значений от 0 до 14, где 7 соответствует нейтральной среде, значения ниже 7 - кислотной, а значения выше 7 - щелочной среде.
Металлические оксиды могут проявлять как кислотные, так и щелочные свойства в растворе. Это зависит от металла, который образует оксид, его электрохимического потенциала и условий реакции.
Некоторые металлические оксиды могут реагировать с водой, образуя кислоты. Например, оксид алюминия (Al2O3) реагирует с водой и образует алюминиевую кислоту (Al(OH)3), что указывает на его кислотные свойства в растворе.
С другой стороны, некоторые металлические оксиды могут реагировать с водой, образуя основания. Например, оксид натрия (Na2O) реагирует с водой и образует щелочь натриевую (NaOH), что указывает на его щелочные свойства в растворе.
Таким образом, металлические оксиды могут проявлять как кислотные, так и щелочные свойства в растворе, в зависимости от химических свойств металла и условий реакции.
Реакция оксидов с водой и образование кислоты

Многие металлические оксиды способны реагировать с водой и образовывать кислоты. Это свойство связано с возможностью оксидов взаимодействовать с водой и превращаться в кислотные растворы.
При взаимодействии оксида с водой происходят химические реакции, в результате которых образуется кислота. Металлический оксид вступает в реакцию с молекулами воды, образуя кислотную формулу. Процесс этой реакции зависит от растворимости оксида в воде и ионизации молекул оксида и воды.
Образование кислоты при реакции оксида с водой обычно сопровождается выделением тепла и образованием гидроксидов или соляных соединений. Эти вещества далее могут реагировать с ионами воды, образуя протон (H+), что и делает раствор кислотным.
Важно отметить, что не все оксиды образуют кислоты при взаимодействии с водой. Некоторые оксиды могут образовывать щелочные растворы или просто быть нерастворимыми в воде. Их кислотность или щелочность зависит от химического состава и свойств оксида. Тем не менее, большинство металлических оксидов имеют кислотные свойства и могут образовывать кислоты при реакции с водой.
Потенциал окислительно-восстановительных свойств оксидов

Металлические оксиды обладают различными окислительно-восстановительными свойствами, которые определяются структурой и электронной конфигурацией оксидов. Потенциал окислительно-восстановительных свойств оксидов является характеристикой их способности к окислению или восстановлению в реакциях с другими веществами.
При реакциях оксидов с другими веществами происходит перераспределение электронов между атомами, что приводит к изменению окислительного состояния элементов. Оксиды, обладающие большим потенциалом окислительных свойств, способны отдавать электроны и окислять вещества, а оксиды с высоким потенциалом восстановительных свойств, напротив, могут принимать электроны и восстанавливать вещества.
Потенциал окислительно-восстановительных свойств оксидов зависит от их химической природы, степени окисления и соседних элементов в периодической системе. Например, оксиды переходных металлов, такие как оксид железа или оксид меди, обладают высокими окислительно-восстановительными свойствами, что делает их полезными в качестве катализаторов и электродных материалов.
Помимо окислительно-восстановительных свойств, потенциал оксидов также определяет их реакционную активность и степень растворимости. Оксиды с высоким потенциалом окислительных свойств обычно являются хорошими окислителями и менее растворимыми в воде, в то время как оксиды с высоким потенциалом восстановительных свойств могут проявлять редукционную активность и быть легко растворимыми в воде.
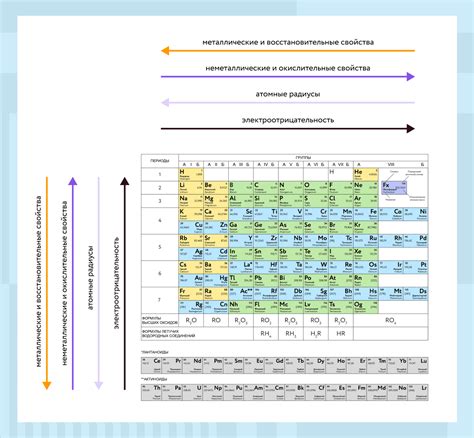
Факторы, влияющие на кислотность оксидов

Кислотность оксидов зависит от некоторых факторов. Один из главных факторов - электроны, которые могут передаваться от оксида к воде. Если оксид высвобождает электроны при контакте с водой, то он обладает кислотными свойствами.
Другой важный фактор - степень окисления металла в оксиде. Оксиды металлов с низкой степенью окисления обычно являются основаниями, а оксиды с высокой степенью окисления могут обладать кислотными свойствами.
Также важно отметить, что кислотность оксидов может быть связана с их положением в периодической системе. Например, оксиды неметаллов, расположенных в верхней части группы "семь", часто обладают кислотными свойствами. Это объясняется тем, что эти элементы имеют высокую электроотрицательность и связаны с большим количеством кислорода в молекуле.
Также важное влияние на кислотность оксидов оказывает растворитель, в котором они находятся. Например, оксиды, которые проявляют кислотные свойства в воде, могут быть нейтральными или основными в других растворителях.
Роль оксидов в химических процессах
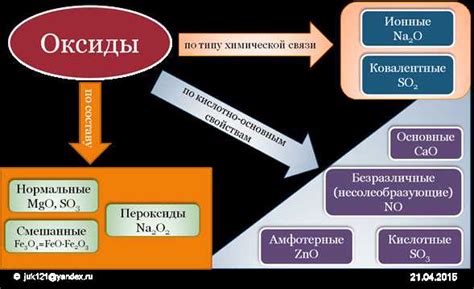
Оксиды - это химические соединения, состоящие из металла и кислорода. Они играют важную роль в химических процессах и имеют различные свойства и функции.
Оксиды могут быть кислотными, щелочными или амфотерными. Кислотные оксиды реагируют с водой, образуя кислоты. Например, оксид серы SO2 реагирует с водой, образуя сульфитную кислоту H2SO3. Щелочные оксиды реагируют с водой, образуя щелочи. Например, оксид натрия Na2O реагирует с водой, образуя гидроксид натрия NaOH.
Амфотерные оксиды могут образовывать как кислоты, так и щелочи. Они реагируют с кислотами и сильными основаниями. Например, оксид цинка ZnO образует цинковый купорос ZnSO4, реагируя с серной кислотой H2SO4, и гидроксид цинка Zn(OH)2, реагируя с гидроксидом натрия NaOH.
Оксиды также являются важными компонентами в производстве стекла, керамики и электроники. Они используются в процессах окисления-восстановления и в качестве катализаторов.
Кроме того, оксиды играют роль в атмосферных процессах. Например, оксид азота NO создается в результате несовершенного сгорания топлива и является одним из причин загрязнения воздуха. Также оксид серы SO2 является главным источником кислотных дождей.
Итак, оксиды играют важную роль в химических процессах, имеют различные свойства и функции, и их влияние охватывает широкий спектр областей - от производства до атмосферных процессов.
Способы использования металлических оксидов
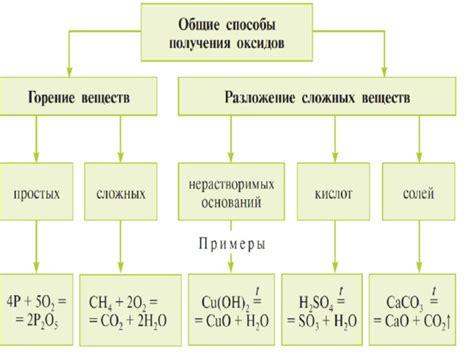
1. Катализаторы: Многие металлические оксиды имеют каталитические свойства и используются в различных процессах химической промышленности. Например, оксид железа (Fe2O3) может использоваться в процессе гидрогенирования органических соединений, а оксид меди (CuO) применяется в процессе окисления алканов.
2. Пигменты: Многие металлические оксиды имеют яркую окраску и используются в производстве красок и пигментов. Например, оксид железа (Fe2O3) используется для создания оранжевых и красных оттенков, а оксид цинка (ZnO) применяется для создания белого цвета.
3. Абразивы: Некоторые металлические оксиды, такие как оксид алюминия (Al2O3), являются твердыми материалами и используются в производстве абразивных средств. Они используются, например, для шлифования и полировки различных поверхностей.
4. Электролиты: Многие металлические оксиды способны проводить электрический ток в определенных условиях. Именно поэтому они широко применяются в производстве электролитов для батарей и аккумуляторов.
5. Керамика: Металлические оксиды также широко используются в производстве керамических материалов. Они могут быть добавлены к глине или другим материалам для придания им определенных свойств и характеристик, таких как прочность, устойчивость к высоким температурам и электрическая проводимость.
Все эти примеры демонстрируют многообразные способы использования металлических оксидов в различных сферах промышленности и технологий.
Вопрос-ответ

Что такое металлические оксиды?
Металлические оксиды представляют собой соединения металлов с кислородом. Они образуются при реакции металлов с кислородом воздуха или при нагреве металлических соединений с кислородом. Металлические оксиды обладают различными свойствами, в зависимости от металла и количества кислорода в соединении.
Какие свойства обладают металлические оксиды?
Свойства металлических оксидов могут быть разнообразными. Некоторые из них имеют кислотные свойства, другие - щелочные или амфотерные. Кислотные оксиды образуют кислотные растворы при реакции с водой. Щелочные оксиды образуют щелочные растворы или гидроксиды при реакции с водой. Амфотерные оксиды могут проявлять как кислотные, так и щелочные свойства в зависимости от условий реакции.
Являются ли металлические оксиды кислотными?
Металлические оксиды могут проявлять кислотные свойства при взаимодействии с водой. Некоторые металлические оксиды образуют кислотные растворы или оксокислоты при растворении в воде. Однако не все металлические оксиды являются кислотными. Некоторые образуют щелочные растворы или гидроксиды, а некоторые могут иметь как кислотные, так и щелочные свойства в зависимости от условий реакции.
