В химии кислотность оксидов играет важную роль при изучении свойств различных веществ. Зависимость между кислотностью оксидов и химическими свойствами металлов главных подгрупп является одной из ключевых тем в этой области науки. Металлы главных подгрупп включают в себя элементы периодической системы с атомным номером от 13 до 18, и они обладают уникальными химическими свойствами.
Оксиды металлов главных подгрупп могут быть как амфотерными, так и основными. Амфотерными называются оксиды, которые могут проявлять как основные, так и кислотные свойства. Это связано с наличием определенной степени электроотрицательности у элементов данных групп. Некоторые металлы из этих подгрупп образуют оксиды, которые растворяются и играют роль сильных оснований, а для других металлов характерны оксиды, которые образуют слабые основания.
Кислотность оксидов металлов главных подгрупп обусловлена их способностью образовывать с кислородом сильные экзотермические реакции. Существует закономерность между кислотностью оксидов и расположением элементов в периодической системе. Так, например, оксиды элементов третьей главной подгруппы обычно обладают кислотными свойствами, в то время как оксиды элементов шестой главной подгруппы могут проявлять основные свойства.
Металлы первой подгруппы

Металлы первой подгруппы в периодической системе химических элементов включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы представляют собой мягкие, низкоплавкие и низкодеформируемые металлы, которые активно реагируют с водой и кислотами.
Металлы первой подгруппы обладают высокой степенью электропроводности и имеют металлический блеск. Они являются отличными проводниками электричества и тепла. Эти металлы легко окисляются воздухом и образуют оксиды, которые имеют высокую кислотность и обладают кислотными свойствами.
Для металлов первой подгруппы характерно образование гидроксидов, которые обладают щелочными свойствами. Например, литий образует гидроксид LiOH, который является сильно щелочным раствором. Натрий образует гидроксид NaOH, который также является сильной щелочью.
Кроме того, металлы первой подгруппы реагируют с кислотами, образуя соли. Это обусловлено их высокой активностью и способностью отдавать электроны. Например, литий реагирует с соляной кислотой HCl, образуя хлорид лития LiCl и выделяя водород.
Суммируя, металлы первой подгруппы обладают высокой кислотностью оксидов, способностью образовывать щелочные гидроксиды и реагировать с кислотами, что делает их важными и широко используемыми элементами в химической промышленности и в различных процессах.
Металлы второй подгруппы
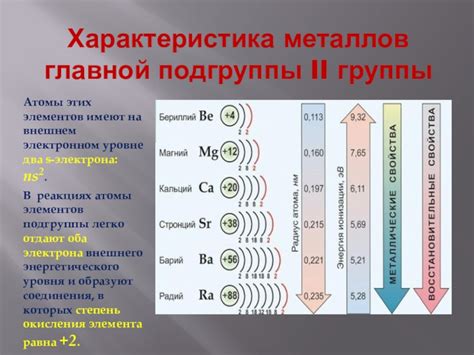
Металлы второй подгруппы характеризуются высокой кислотностью окислов и способностью образовывать ионные соединения с анионами не только кислорода, но и других элементов.
Антиоксиды второй подгруппы металлов обладают сильной окислительной активностью и способны образовывать оксиды с высокой степенью окисления, например, MnO4, Cr2O7, CrO5, CrO4 и Mn2O7.
Металлы второй подгруппы в реакциях с водородом образуют сильные основания, например, BaH2, CaH2 и SrH2. Они также способны образовывать сольсодержащие гидриды с анионами и другими металлами, например, MgH2.
Амфотерностью отличаются соединения алюминия и цинка – они могут реагировать как с кислотами, так и с щелочами, образуя соли и воду, например, Al(OH)3+3HCl→AlCl3+3H2O.
Также характерными свойствами второй подгруппы металлов являются способность образовывать соединения с низкой координационной численностью, например, ZnCl2 и MgCl2, а также образование соединений с комплексными ионами, например, Cs[CoCl4].
Металлы третьей подгруппы
Металлы третьей подгруппы переходных металлов характеризуются особыми свойствами и уникальными особенностями в своей кислотности оксидов. В эту подгруппу включены такие элементы, как хром (Cr), марганец (Mn), железо (Fe), кобальт (Co), никель (Ni) и медь (Cu).
Кислотность оксидов металлов третьей подгруппы обусловлена их способностью образовывать не только катионы, но и различные анионы, что не характерно для других подгрупп. Например, марганец может образовывать не только анион марганата (MnO4-), но и анион перманганата (MnO42-). Это позволяет этим металлам образовывать более кислотные оксиды и проявлять большую активность в реакциях.
Металлы третьей подгруппы также проявляют различие в степени окисления, что влияет на их кислотность. Например, хром может иметь окисление +2, +3, +4, +5 и +6, и в зависимости от степени окисления образуются разные оксиды. Оксид хрома (III) является амфотерным и может проявлять кислотные и основные свойства в зависимости от реагента, с которым взаимодействует.
Также металлы третьей подгруппы проявляют свойства легирования других металлов. Например, никель является одним из основных компонентов нержавеющей стали, а железо и кобальт используются в производстве магнитов. Это свойство делает их важными материалами в различных областях промышленности и технологий.
Металлы четвертой подгруппы
Металлы четвертой подгруппы в периодической системе Менделеева включают титан (Ti), цирконий (Zr) и гафний (Hf). Эти металлы обладают схожими химическими свойствами и имеют сильную ковалентную природу связи.
Металлы четвертой подгруппы обладают высокой термической и химической стойкостью, что делает их незаменимыми материалами в различных отраслях промышленности, включая авиацию, строительство и электронику.
Титан является одним из самых легких и прочных металлов и обладает высокой коррозионной стойкостью. Он часто используется в производстве авиационных и космических конструкций, а также в медицине для создания имплантатов и ортопедических конструкций.
Цирконий обладает высокой стойкостью к коррозии, является хорошим проводником тепла и электричества. Он применяется в производстве ядерных реакторов, а также в химической, нефтяной и атомной промышленности.
Гафний обладает аналогичными свойствами циркония и также используется в ядерной промышленности и при производстве специальных сплавов.
Вопрос-ответ

Что такое кислотность оксидов?
Кислотность оксидов - это их способность образовывать кислоты при реакции с водой или сильной щелочью.
Как классифицируются оксиды по кислотности?
Оксиды делятся на кислотные, основные, амфотерные и нейтральные в зависимости от их способности образовывать кислоты, щелочи или не реагировать с водой.
Какая связь между металлами и кислотностью оксидов?
Металлы главных подгрупп периодической системы могут образовывать различные оксиды, кислотность которых зависит от их электрохимических свойств и электроотрицательности металла.
Каким образом металлы главных подгрупп могут влиять на кислотность оксидов?
Металлы главных подгрупп могут образовывать оксиды с различной степенью окисления, что определяет их кислотность. К примеру, оксиды некоторых металлов главной подгруппы I могут быть щелочными, а оксиды металлов главной подгруппы II - кислотными.
