Кислотные оксиды металлов – это химические соединения металлов с кислородом, которые проявляют кислотные свойства. Они образуются в результате реакции металлического оксида с водой или кислотой. Кислотные оксиды металлов являются важными сырьевыми компонентами в химической и металлургической промышленности.
Основные характеристики кислотных оксидов металлов:
- Кислотные оксиды металлов обладают высокой активностью и способностью реагировать с водой или кислотами. Это свойство позволяет им использоваться в процессе синтеза различных химических соединений.
- Многие кислотные оксиды металлов обладают высокой термической стабильностью, что позволяет использовать их в процессе нагревания и обработки материалов при высоких температурах.
- Химическая формула кислотных оксидов металлов обычно состоит из символов металла и кислорода, причем кислород может присутствовать в различных степенях окисления. Например, оксид железа Fe3O4 содержит атом железа с валентностью 3 и атом кислорода с валентностью 4.
Кислотные оксиды металлов имеют широкий спектр применений. Их используют в производстве косметики, лакокрасочных материалов, стекла, керамики, а также в электронике и металлургии. Некоторые кислотные оксиды металлов обладают также полезными свойствами при лечении различных заболеваний и используются в фармацевтике.
В заключение, кислотные оксиды металлов – это важные химические соединения с высокой активностью и разнообразным применением в различных отраслях промышленности.
Характеристики кислотных оксидов металлов
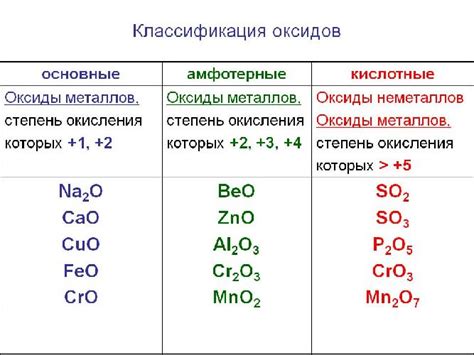
Кислотные оксиды металлов - это соединения, которые формируются при реакции металлов с кислородом. Они обладают рядом характерных свойств, важных для понимания их химической природы и использования в различных областях.
Первым и наиболее характерным свойством кислотных оксидов металлов является их кислотность. В растворе они образуют кислоты, которые реагируют с основаниями, образуя соль и воду. Кислотность оксидов металлов связана с их способностью отдавать протоны.
Вторым важным свойством кислотных оксидов металлов является их реакционная способность. Они обладают способностью взаимодействовать с веществами, образуя разнообразные соединения. Например, оксиды алюминия и железа активно взаимодействуют с кислотами, аммиаком и многими другими веществами.
Третье важное свойство кислотных оксидов металлов — их способность определять физико-химические свойства соединений. Они сильно влияют на температурную устойчивость, цветность, проводимость электричества и другие характеристики соединений, в которых они присутствуют.
Для полного понимания характеристик кислотных оксидов металлов, необходимо ознакомиться с их химической формулой, которая показывает состав и соотношение элементов в соединении. Структурные особенности молекулы оксида металла также влияют на его свойства и взаимодействие с другими веществами.
Химическая формула кислотных оксидов металлов
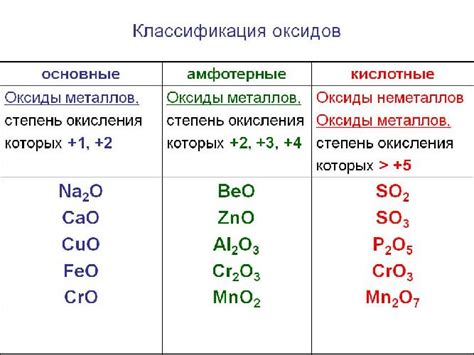
Кислотные оксиды металлов представляют собой соединения, образованные металлами и кислородом. Они имеют химическую формулу, которая отражает соотношение атомов элементов в соединении.
Химическая формула кислотных оксидов металлов может быть представлена различными способами, но наиболее распространенным является формула, в которой указывается символ металла, а затем символ кислорода с указанием количества атомов. Например, оксид алюминия имеет формулу Al2O3, что означает, что в соединении присутствуют два атома алюминия и три атома кислорода.
Некоторые кислотные оксиды металлов имеют дополнительные элементы в своей формуле. Например, оксид железа, также известный как ржавчина, имеет формулу Fe2O3, где указаны два атома железа и три атома кислорода.
Химическая формула кислотных оксидов металлов является важной характеристикой этих соединений, так как она указывает на количество и тип элементов, входящих в состав соединения. Формула позволяет определить химические свойства и реакционную способность кислотных оксидов металлов и использовать их в различных процессах и промышленности.
Основные свойства кислотных оксидов металлов
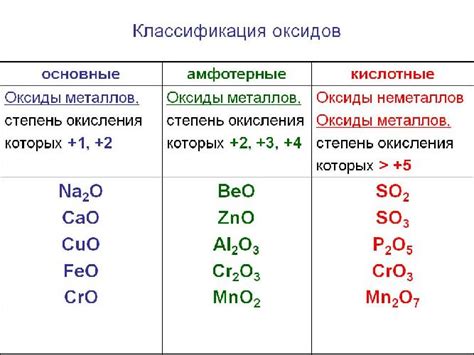
Кислотные оксиды металлов являются химическими соединениями, которые обладают рядом характерных свойств.
- Кислотность: Кислотные оксиды металлов образуют кислотные растворы при реакции с водой. Это свойство проявляется в реакции, известной как гидратация, когда оксид и вода взаимодействуют, образуя кислоту и выделяя тепло.
- Электроотрицательность: Кислотные оксиды металлов обладают высокой электроотрицательностью, что позволяет им образовывать кислоты при контакте с водой. Они способны отбирать электроны у воды, что приводит к образованию ионов водорода и оксидов металлов.
- Растворимость: Кислотные оксиды металлов обычно хорошо растворяются в воде и образуют кислотные растворы. Однако некоторые из них, такие как оксид алюминия, плохо растворимы и образуют гидроксиды с щелочной реакцией.
- Химическая формула: Кислотные оксиды металлов имеют химическую формулу, в которой указан металл и кислород. Например, оксид железа(III) имеет формулу Fe2O3, а оксид меди(I) - Cu2O.
- Формирование солей: Кислотные оксиды металлов могут реагировать с основаниями и образовывать соли. Это свойство используется при получении металлов из их руд при помощи процесса обогащения.
Вопрос-ответ

Какие металлы образуют кислотные оксиды?
Кислотные оксиды образуют большинство металлов из периодической системы, такие как оксиды марганца, железа, алюминия, цинка и других.
Что такое кислотный оксид?
Кислотный оксид - это оксид металла, который реагирует с водой, образуя кислоту. У него кислотные свойства и растворяется в воде, образуя кислоту.
Какова химическая формула кислотных оксидов?
Химическая формула кислотных оксидов зависит от металла: MnO - оксид марганца, Fe2O3 - оксид железа, Al2O3 - оксид алюминия, ZnO - оксид цинка и т.д.
Какие свойства обладают кислотные оксиды металлов?
Кислотные оксиды металлов имеют кислотные свойства, т.е. они реагируют с водой, образуя кислоту. Они также могут растворяться в воде и образовывать растворимые соли.
