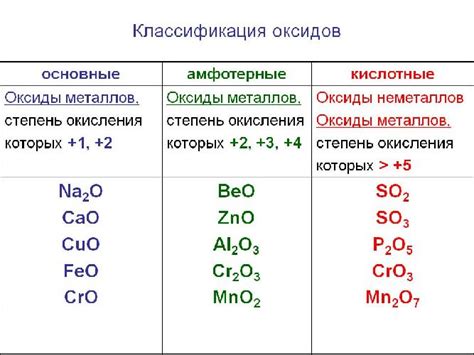
Оксиды металлов - это химические соединения, состоящие из кислорода и одного или нескольких металлических элементов. Взаимодействие оксидов металла с водой или кислотами может проявляться в различных свойствах. Кислотные свойства оксида металла определяют его способность образовывать с кислотами соли и воду.
Наиболее выраженная особенность кислотных свойств оксида металла заключается в том, что они могут реагировать с кислотами, образуя соли и воду. Именно эта реакция обуславливает способность металлов к ожогам при контакте с кожей или слизистыми. Например, оксид алюминия (Al2O3) реагирует с сильными кислотами, такими как серная (H2SO4), образуя сульфат алюминия (Al2(SO4)3) и воду.
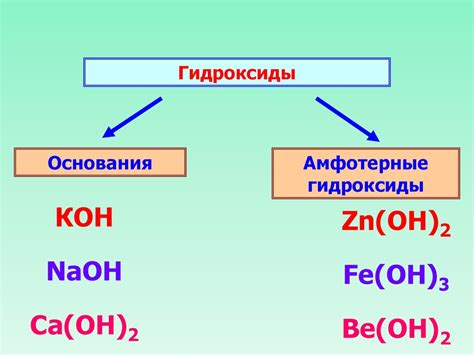
Оксиды металлов могут проявлять как кислотные, так и основные свойства в зависимости от окислительно-восстановительных свойств металла. Например, оксиды щелочных металлов, такие как оксид натрия (Na2O) или оксид калия (K2O), проявляют выраженные основные свойства. При реакции с водой они образуют гидроксиды соответствующих металлов, высвобождая щелочные растворы.
Кислотные свойства оксида металла могут быть использованы в различных областях, таких как производство аккумуляторов, катализ и металлургия. Знание этих свойств позволяет контролировать реакции между оксидами металлов и другими веществами, что важно для разработки новых материалов и процессов.
Оксид металла: его кислотные свойства
Оксид металла - это химическое соединение металла с кислородом. В зависимости от свойств его можно отнести либо к основаниям, либо к кислотам. Основной характеристикой оксида металла в отношении его кислотных свойств является его реакция с водой.
Когда оксид металла растворяется в воде, образуется соответствующее гидроксидное основание. В этой реакции металл совершает переход от кислородной формы к гидроксидной форме. Например, оксид натрия (Na2O) растворяется в воде, образуя гидроксид натрия (NaOH).
Характер и скорость этой реакции зависят от свойств металла. Некоторые оксиды металлов растворяются в воде с мгновенным образованием гидроксидов, в то время как другие металлы могут не проявлять реакции с водой вообще.
Важно отметить, что оксиды металлов могут также реагировать с кислотами. В этом случае образуется соль и вода. Например, оксид кальция (CaO) может реагировать с соляной кислотой (HCl), образуя хлорид кальция (CaCl2) и воду (H2O).
Таким образом, оксиды металлов обладают выраженными кислотными свойствами, проявляющимися в реакциях с водой и кислотами. Это отличает их от других соединений металлов и определяет их роль в химических реакциях.
Наиболее выраженные особенности

Кислотные свойства оксида металла определяются свойствами металла, а именно его электроотрицательностью и степенью окисления. Наиболее выраженные особенности кислотности оксида металла связаны с его способностью образовывать кислоты при взаимодействии с водой.
Взаимодействие оксида металла с водой приводит к образованию кислоты и основы. Каждый оксид металла образует свою уникальную кислоту, которая имеет свои химические и физические свойства. Кислоты, образующиеся при реакции оксида металла с водой, могут быть как минеральными, так и органическими.
Еще одной особенностью кислотных свойств оксида металла является его растворимость в воде. Некоторые оксиды металлов растворяются легко и образуют кислоту, а некоторые плохо растворяются или вообще не растворяются. Это зависит от химического состава оксида, его кристаллической структуры и других факторов.
Также важным аспектом кислотных свойств оксида металла является его активность. Некоторые оксиды металлов проявляют высокую активность и быстро взаимодействуют с водой, образуя кислоты. Другие оксиды металлов могут быть менее активными и могут требовать дополнительных условий для реакции с водой.
Химический состав и строение оксидов металлов

Оксиды металлов - это неорганические соединения, состоящие из оксигена и металлического элемента. Их химический состав и строение зависят от металла, с которым они связаны.
Основные оксиды металлов представлены соединениями, в которых металл образует положительный ион, а оксиген - отрицательный ион. Например, оксид кальция имеет формулу CaO, где Ca+ является ионом кальция, а O- - ионом оксигена.
Структура оксидов металлов может быть различной. Некоторые оксиды имеют ионно-кристаллическую структуру, где металлические ионы окружены ионами оксигена. Другие оксиды могут образовывать молекулярные соединения, где атомы металла и оксигена соединены ковалентными связями.
Оксиды металлов могут также образовывать сложные соединения, в которых кислород связан не только с одним металлом, но и с другими элементами или группами элементов. Например, в оксидах переходных металлов, металл связан не только с кислородом, но и с другими элементами, такими как алюминий или кремний.
Химический состав и строение оксидов металлов определяют их свойства и реакционную способность. Некоторые оксиды металлов обладают кислотными свойствами, способностью реагировать с водой и образовывать растворимые соли. Другие оксиды металлов, напротив, могут образовывать основные растворы, способные нейтрализовать кислоты.
Таким образом, химический состав и строение оксидов металлов играют важную роль в их химических свойствах и влияют на их возможности взаимодействия с другими веществами.
Влияние молекулярной структуры на кислотные свойства
Одним из важных факторов, влияющих на кислотные свойства оксида металла, является его молекулярная структура. Молекулярная структура определяется типом связей между атомами в оксиде и их ароматической или циклической организацией.
Некоторые оксиды металлов обладают кислотными свойствами благодаря наличию кислородных групп, которые могут быть донорами электронов. Такие оксиды металлов называются оксокислотами. Они способны реагировать с водой, образуя кислотное растворение. Это происходит за счет атомов кислорода, которые обладают отрицательным электрическим зарядом и могут протонироваться.
Другие оксиды металлов, например, оксид натрия или оксид магния, не обладают кислотными свойствами. В этих соединениях атомы кислорода не имеют отрицательного заряда и не могут донорировать электроны. Эти оксиды металлов называются основаниями и способны образовывать щелочные растворы в воде.
Кроме того, молекулярная структура оксида металла может влиять на его способность реагировать с кислотами. Например, оксид алюминия образует кислотные растворы при реакции с кислотами, такие как соляная кислота. Это происходит из-за наличия двух типов связей атомов кислорода с атомами алюминия, которые при контакте с кислотой могут образовывать положительные ионы алюминия и отрицательные ионы кислорода.
Примеры оксидов металлов с выраженными кислотными свойствами:
1. Оксид серы (IV) или диоксид серы (SO2) - один из наиболее известных и распространенных оксидов металлов со сильными кислотными свойствами. Он образуется при сжигании серы или серной руды. Диоксид серы обладает способностью реагировать с водой, образуя сульфитные кислоты. Данный оксид также может реагировать с основаниями, образуя сульфаты металлов.
2. Оксид азота (II) или оксид азота (NO) - вещество с выраженными кислотными свойствами, которое образуется в результате горения азота в воздухе при высоких температурах. Оксид азота (II) реагирует с водой, образуя азотную кислоту (HN3). Он также может реагировать с основаниями, образуя нитриты металлов.
3. Оксид фосфора (V) или пентоксид фосфора (P2O5) - один из самых ярких примеров оксидов металлов с выраженными кислотными свойствами. Он образуется при сжигании фосфора в присутствии кислорода. Пентоксид фосфора реагирует с водой, образуя фосфорную кислоту (H3PO4). Также он может реагировать с основаниями, образуя фосфаты металлов.
4. Оксид серы (VI) или триоксид серы (SO3) - еще один пример оксида металла с ярко выраженными кислотными свойствами. Он образуется при окислении диоксида серы при высоких температурах. Триоксид серы реагирует с водой и образует серную кислоту (H2SO4). Он также реагирует с основаниями, образуя сульфаты металлов.
Вопрос-ответ

Что такое кислотные свойства оксида металла?
Кислотные свойства оксида металла связаны с его способностью образовывать с кислородом кислоту. Оксид металла реагирует с водой или кислотой, образуя ион металла и ион гидроксида или соли.
Какие основные особенности кислотных свойств оксида металла?
Основные особенности кислотных свойств оксида металла включают его способность образовывать кислоту при реакции с водой или кислотой, а также образование ионов металла и ионов гидроксида или солей.
Как оксид металла может реагировать с водой?
Оксид металла может реагировать с водой, образуя гидроксид металла. Во время реакции ион металла отщепляется от оксида и образует гидроксид, который в свою очередь может быть сильной или слабой кислотой в зависимости от своей реакции с водой.
Какие металлы проявляют наиболее выраженные кислотные свойства?
Наиболее выраженные кислотные свойства проявляют оксиды металлов группы переходных элементов, таких как железо, алюминий, кобальт и многие другие. Эти оксиды могут легко образовывать кислоты при контакте с водой или кислотами.
Какие факторы влияют на выраженность кислотных свойств оксида металла?
Выраженность кислотных свойств оксида металла зависит от нескольких факторов, включая электрохимические свойства металла, его реакционную способность и концентрацию ионов металла в оксиде. Также важными факторами являются pH раствора и температура, при которой происходит реакция.
