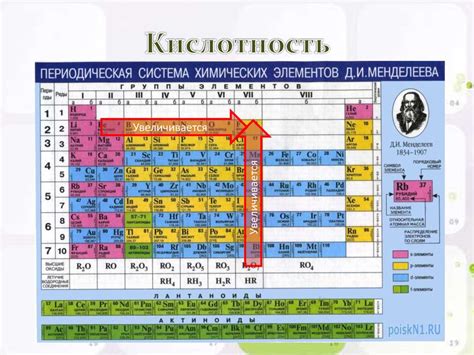
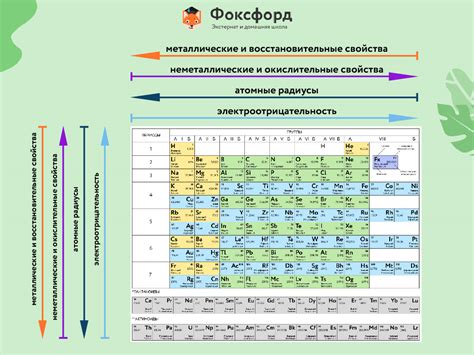
В химии существует классификация элементов на металлы и неметаллы, которая базируется на их химических свойствах. Одним из важных свойств химических элементов является их кислотность. Кислотность позволяет определить, способны ли элементы образовывать кислоты или принимать участие в реакциях с кислотами.
Металлы, как правило, имеют более низкую кислотность, поскольку они склонны отдавать электроны и образовывать катионы при взаимодействии с кислотами. Этот процесс называется окислением. Самым известным примером металлического взаимодействия с кислотой является реакция железа с соляной кислотой, при которой образуется хлорид железа и выделяется водород.
С другой стороны, неметаллы проявляют более высокую кислотность, поскольку они имеют тенденцию принимать электроны и образовывать анионы при взаимодействии с кислотами. Этот процесс называется восстановлением. Например, сера может реагировать с сильными кислотами, такими как серная кислота, образуя соответствующие соли и выделяяся диоксид серы.
Важно отметить, что кислотные свойства элементов в значительной степени зависят от их положения в периодической таблице. Некоторые элементы, такие как группа алкалинных металлов, проявляют очень высокую кислотность, в то время как другие элементы, например, инертные газы, почти не реагируют с кислотами.
Итак, кислотные свойства элементов являются важным аспектом изучения химических реакций и могут быть использованы для предсказания их поведения при взаимодействии с кислотами. Понимание этих свойств позволяет ученым и исследователям более точно определить возможные реакции и разработать новые материалы с нужными химическими свойствами.
Кислотные свойства металлов и неметаллов

Металлы:
Металлы обладают способностью образовывать ионные соединения с неметаллами, демонстрируя при этом кислотные свойства. Это связано с тем, что при растворении в воде они образуют положительно заряженные ионы - катионы, которые способны занимать активные центры кислотных соединений.
Однако, не все металлы обладают ярко выраженными кислотными свойствами. Некоторые из них не способны растворяться в воде и образовывать ионные соединения. Но даже в таких случаях можно наблюдать некоторые кислотные реакции с другими соединениями, например, с кислородом.
Примеры металлов с кислотными свойствами:
- Алюминий
- Цинк
- Свинец
- Железо
Неметаллы:
Неметаллы также могут проявлять кислотные свойства, однако, они образуют отрицательно заряженные ионы - анионы. Это связано с тем, что они имеют высокую электроотрицательность и способны принимать электроны в процессе реакции.
Кислотные свойства неметаллов проявляются в реакциях с основаниями и металлами. При этом образуются соли и вода. Некоторые неметаллы, такие как хлор и сера, способны образовывать кислоты, которые растворяются в воде и обеспечивают кислотную среду.
Примеры неметаллов с кислотными свойствами:
- Кислород
- Карбон
- Фосфор
- Сера
Кислотность металлов
Металлы – это элементы, которые обладают характерными физическими и химическими свойствами. Одним из важных свойств металлов является их способность проявлять кислотные свойства.
В отличие от неметаллов, металлы образуют ионы металла с положительным зарядом, поэтому их свойства более схожи с водородными ионами H+. Таким образом, когда металл взаимодействует с водой, образуется щелочь и выделяется водород.
Металлы, проявляющие выраженные кислотные свойства, называют кислотными металлами. Они образуют с кислотами соли, которые в растворе образуют ионы металла и анионы кислоты. Примером кислотного металла может служить натрий (Na), который реагирует с кислородом воды и выделяет водород, образуя щелочь натрия (NaOH).
Кислотность металлов имеет широкое применение во многих областях. Кислотные металлические соединения, такие как серная кислота, используются в промышленности для производства удобрений, пластиков, фармацевтических препаратов и многих других продуктов. Благодаря своей кислотности, металлы могут быть использованы для улучшения качества почвы и воды.
Неметаллы и их кислотные свойства
Неметаллы - это класс элементов, характеризующихся отсутствием металлических свойств и образованием кислотных соединений при взаимодействии с металлами. Хотя неметаллы в основном известны своими химическими реакциями в качестве оксидов или галогенов, они также обладают кислотными свойствами, которые имеют важное значение в мире химии и промышленности.
В то время как металлы обладают основными свойствами, неметаллы являются кислотными в природе и имеют способность образовывать кислотные соединения. Например, хлор является неметаллом, который прекрасно известен своим кислотным поведением, образуя кислоту с водородом – соляную кислоту. Это хорошо иллюстрирует кислотные свойства неметаллов и их значимость в химических реакциях.
Другой пример неметалла, обладающего кислотными свойствами, - сера. При взаимодействии серы с кислородом образуется диоксид серы, который взаимодействует с водой, образуя серный оксид. В результате образуется сульфурная кислота, которая широко используется в индустрии и находит применение в различных химических процессах.
Таким образом, кислотные свойства неметаллов играют важную роль в реакциях их взаимодействия с металлами, оксидами и другими веществами. Это позволяет нам понимать и изучать химические процессы, происходящие в природе и в промышленности, и применять их в различных сферах деятельности.
Металлы и их взаимодействие с кислотами
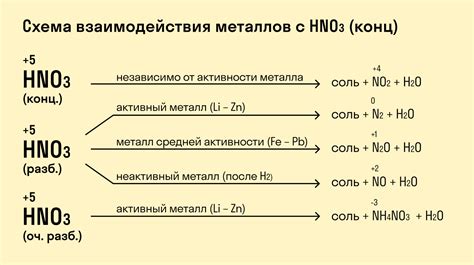
Металлы обладают способностью взаимодействовать с кислотами и образовывать с ними соли и водород. Это свойство определяется химической природой металлов и их способностью отдавать электроны.
Кислоты – это вещества, способные отдавать протоны. Реакция металлов с кислотой протекает по следующей схеме: металл отдает электроны, образуя положительно заряженные ионы, которые реагируют с отрицательно заряженными ионами кислоты, образуя соль и водород. Образовавшийся водород появляется в виде пузырьков, сопровождаемых характерным шипением.
Металлы можно разделить на активные и пассивные. Активные металлы, такие как натрий и калий, реагируют с кислотами очень быстро и интенсивно. При этом выделяется большое количество газа и энергии. Пассивные металлы, такие как железо и цинк, вступают в реакцию с кислотами гораздо медленнее и менее интенсивно.
Реакция металлов с кислотами широко используется в промышленности и научных исследованиях. Это позволяет получать различные металлические соединения и использовать их в различных областях, таких как производство батареек, металлических солей и других химических соединений.
Неметаллы и их химические реакции с кислотами

Неметаллы - это элементы, которые не обладают металлическими свойствами и не могут проводить электрический ток. Они имеют отличную от металлов структуру и химические свойства.
Когда неметаллы вступают в реакцию с кислотами, происходят различные химические превращения. Неметаллы могут действовать как складывающиеся или отдельные компоненты кислотного соединения.
Ионное соединение образуется, когда неметалл вступает в реакцию с кислотой и отделяет ионы водорода от кислоты. Это происходит, например, при реакции неметалла серы с кислотой серной:
- Сера + кислота серная → сульфат водорода
- S + H2SO4 → H2SO4
Замещение водорода происходит, если неметалл отделяет водород от молекулы кислоты и себя встраивает в структуру соединения. Этот процесс может протекать при реакции хлора с кислотой хлороводородной:
- Хлор + кислота хлороводородная → хлорид
- Cl2 + 2HCl → 2Cl-
Когда неметалл вступает в реакцию с кислородным кислотами, возможно образование оксокислот. В таких случаях неметалл участвует в образовании более сложного соединения, содержащего кислород и другие элементы. Примером может служить реакция серы с кислотой серной:
- Сера + кислота серная + кислород → сульфат
- S + 2H2SO4 + O2 → 2H2SO4
Таким образом, неметаллы могут вступать в различные химические реакции с кислотами, образуя ионные соединения, замещая водород или образуя оксокислоты. Эти реакции отличаются по характеру и условиям протекания и служат основой для понимания кислотных свойств неметаллов.
Особенности реакций между металлами и неметаллами

Металлы и неметаллы обладают совершенно разными свойствами и химическими реакциями. Когда металлы взаимодействуют с неметаллами, происходят особенные реакции, в которых переходят электроны. Это связано с различием электроотрицательности и электронной структурой веществ.
Наиболее известной и наглядной реакцией между металлом и неметаллом является гидролиз металлической неметалла. Например, если поместить кусочек натрия (Na) в воду, наблюдается сильное образование газа водорода (H2) и образование щелочной среды. Это объясняется тем, что натрий обладает сверхнизкой электроотрицательностью и готов отдать свои электроны воде, образуя ион Na+ и гидроксид и неметалл водород.
Также, реакция между металлами и неметаллами может приводить к образованию солей. Например, реакция между натрием и хлором приводит к образованию хлорида натрия (NaCl) - обычной кухонной соли. В этом случае натрий отдает свои электроны хлору, образуя положительно заряженный ион Na+ и отрицательно заряженный ион Cl-, которые притягиваются друг к другу и образуют кристаллическую сетку хлорида натрия.
Стоит отметить, что реакции между металлами и неметаллами могут проявляться в разных формах и условиях. Например, некоторые металлы могут реагировать с неметаллами даже при комнатной температуре, образуя новые вещества и выделяя тепло. Другие реакции могут происходить только при нагреве или под воздействием катализаторов.
В целом, реакции между металлами и неметаллами являются важной частью химии, позволяющей получать новые вещества с различными свойствами и применением в разных областях науки и промышленности.
Вопрос-ответ

Какие свойства отличают металлы от неметаллов в кислотных реакциях?
Металлы обладают способностью образовывать положительные ионы (катионы) при реакции с кислотами. Неметаллы же, наоборот, образуют отрицательные ионы (анионы).
Почему металлы образуют положительные ионы в кислотных реакциях?
Металлы отдают электроны в кислотную среду, образуя положительные ионы. Это связано с их строением и электронной конфигурацией. Металлы имеют относительно мало электронов в внешней электронной оболочке, и они легко могут отдать эти электроны для образования положительного иона.
Какие неметаллы могут образовывать отрицательные ионы в кислотных реакциях?
Неметаллы, имеющие большую электроотрицательность, могут образовывать отрицательные ионы в кислотных реакциях. Примерами таких неметаллов являются кислород, хлор, сера и фтор.
Почему неметаллы образуют отрицательные ионы в кислотных реакциях?
Неметаллы имеют высокую электроотрицательность и способность привлекать электроны. Поэтому взаимодействуя с кислотами, неметаллы привлекают электроны к себе и образуют отрицательные ионы. Это связано с их строением и электронной конфигурацией.
Какие металлы могут образовывать положительные ионы в кислотных реакциях?
В принципе, большинство металлов могут образовывать положительные ионы в кислотных реакциях. Однако, некоторые металлы, такие как литий, натрий и калий, обычно образуют ионы однозарядные, а некоторые, как железо, медь и цинк, могут образовывать ионы разных зарядов.
