Оксиды металлов являются важной группой химических соединений, которые играют значительную роль в различных промышленных процессах и естественных явлениях. Одной из их разновидностей являются кислотные оксиды.
Кислотные оксиды – это оксиды металлов, которые обладают кислотными свойствами. Они образуются при взаимодействии металлов с кислородом, при этом кислород приобретает отрицательный заряд. Кислотные оксиды обычно обладают выраженной кислотностью и могут реагировать с щелочными растворами, образуя соли и воду.
Среди наиболее известных кислотных оксидов металлов можно назвать оксиды серы (SO2), азота (NO) и хлора (Cl2O). Оксид серы образуется при сжигании серы в кислороде и обладает резким запахом, являясь одной из причин возникновения кислотных дождей. Оксид азота образуется при сгорании азота в воздухе и способен вызывать реакции окисления в организмах, что может нанести вред здоровью. Оксид хлора является мощным окислителем и может вызывать раздражение при контакте с кожей и глазами.
Что такое кислотные оксиды металлов и их свойства
Кислотные оксиды металлов – это химические соединения, образуемые при соединении металлов с кислородом. Они отличаются тем, что реагируют с водой, образуя кислоты. Кислотные оксиды металлов могут иметь различные степени окисления, что влияет на их свойства и реактивность.
Одной из важных характеристик кислотных оксидов металлов является их способность образовывать кислоты при контакте с водой. При этом реакции могут протекать с различной интенсивностью в зависимости от свойств оксида и металла. Некоторые кислотные оксиды формируют кислоты сильно выраженной кислотностью, в то время как другие могут образовывать более слабые кислоты.
Свойства кислотных оксидов металлов также могут быть связаны с их реакцией с другими соединениями и элементами. Некоторые оксиды могут образовывать соли при контакте с основаниями или гидроксидами, что свидетельствует о их кислотно-основных свойствах. Кроме того, реакции кислотных оксидов металлов с другими оксидами или элементами могут приводить к образованию сложных соединений с различными свойствами.
Важно отметить, что кислотные оксиды металлов могут быть использованы в различных отраслях промышленности и науки. Например, некоторые кислотные оксиды используются в процессе получения качественно чистых металлов, а другие – для производства различных химических соединений. Изучение свойств и реакций кислотных оксидов металлов является важной задачей для понимания и использования этих соединений в различных сферах деятельности.
Список кислотных оксидов металлов:

1. Оксид алюминия (Al2O3) - кислотный оксид, который образует кислоту алюминия (Al(OH)3), используемую в производстве керамики, стекла и других материалов.
2. Оксид серы (SO2) - кислотный газ, образующийся при сжигании серы. Этот оксид может реагировать с водой, образуя сульфитную кислоту.
3. Оксид азота (NO2) - кислотный газ, который образуется при сжигании топлива в автомобильных двигателях. Этот оксид может реагировать с водой, образуя азотную кислоту.
4. Оксид железа (Fe2O3) - кислотный оксид, который может реагировать с водой, образуя железную кислоту (H2FeO4), используемую в окислительных и катализаторных процессах.
5. Оксид меди (CuO) - кислотный оксид, который может реагировать с водой, образуя медную кислоту (Cu(OH)2), используемую в производстве пигментов и биологически активных соединений.
6. Оксид цинка (ZnO) - кислотный оксид, который может реагировать с водой, образуя цинковую кислоту (Zn(OH)2), применяемую в медицине и фармацевтической промышленности.
7. Оксид свинца (PbO) - кислотный оксид, который может реагировать с водой, образуя плумбитовую кислоту (Pb(OH)2), используемую в производстве аккумуляторов и керамики.
8. Оксид антимона (Sb2O3) - кислотный оксид, который может реагировать с водой, образуя антимоновую кислоту (H3SbO4), применяемую в производстве стекла, электроизоляционных материалов и противогрибковых препаратов.
Основные свойства кислотных оксидов металлов:
1. Кислотные оксиды металлов обладают выраженной кислотностью. Они реагируют с водой, образуя кислоты. Например, оксид серы SO3 с водой образует серную кислоту H2SO4, а оксид азота NO2 с водой образует азотистую кислоту HNO2.
2. Кислотные оксиды металлов обладают высокой электроотрицательностью. Это свойство позволяет им образовывать ионные соединения с щелочными оксидами. Например, кислотный оксид алюминия Al2O3 реагирует с щелочным оксидом натрия Na2O, образуя соль - алюмо-натриевый силикат NaAlSiO4.
3. Кислотные оксиды металлов могут взаимодействовать с основаниями, образуя соли. Например, оксид железа Fe2O3 реагирует с гидроксидом натрия NaOH, образуя соль - гидроксид железа Fe(OH)3.
4. Присутствие кислотных оксидов металлов в атмосфере может приводить к образованию кислотных осадков, оказывающих вредное влияние на растения и животных. Например, оксид серы SO2 при попадании в атмосферу смешивается с водой и образует серную кислоту, которая является главной составляющей кислотных дождей.
Как образуются кислотные оксиды металлов:
Кислотные оксиды металлов образуются в результате реакции металлов с кислородом. При высоких температурах металлы реагируют с кислородом воздуха, образуя оксиды. В зависимости от степени окисления, оксиды могут иметь различные свойства и действовать как кислоты.
Образование кислотных оксидов металлов основывается на способности металла отдавать электроны при взаимодействии с кислородом. При этом металл окисляется, а кислород восстанавливается. Реакция происходит по следующей схеме:
- Металл реагирует с кислородом
- Происходит образование оксида металла
- Металл отдает электроны, кислород их принимает
- Металл окисляется, кислород восстанавливается
Кислотные оксиды металлов характеризуются следующими свойствами:
- Образуют кислотные растворы при растворении в воде
- Проявляют кислотные свойства в химических реакциях, например, с щелочами или солями
- Могут иметь кристаллическую структуру и быть твердыми веществами
- Могут быть использованы в промышленности для производства кислот и других соединений
Примеры кислотных оксидов металлов включают оксиды серы, серы, азота и других элементов.
Химические реакции с участием кислотных оксидов металлов:

Кислотные оксиды металлов обладают рядом химических свойств, наиболее характерным из которых является их реакция с водой. В результате такой реакции образуется киселый оксид, что обуславливает их название. Например, оксид алюминия (Al2O3) при взаимодействии с водой образует алюминиевую кислоту (Al(OH)3).
Кислотные оксиды металлов также могут реагировать с щелочами, образуя соли. Например, оксид цинка (ZnO) при взаимодействии с гидроксидом натрия (NaOH) образует соль - гидроксид цинка (Zn(OH)2).
Еще одной типичной реакцией кислотных оксидов металлов является их реакция с кислотами. В ходе этой реакции оксид металла реагирует с кислотой, образуя соответствующую соль и воду. Например, оксид железа (Fe2O3) при взаимодействии с соляной кислотой (HCl) образует соль - хлорид железа (FeCl3) и воду.
Также кислотные оксиды металлов могут реагировать с основаниями, образуя соли и воду. Например, оксид кальция (CaO) при взаимодействии с гидроксидом калия (KOH) образует соль - гидроксид кальция (Ca(OH)2) и воду.
Применение кислотных оксидов металлов в промышленности:

Кислотные оксиды металлов – это соединения, которые обладают кислотными свойствами и содержат один или несколько металлов. Их применение в промышленности очень разнообразно и широко, благодаря их уникальным химическим и физическим свойствам.
Одним из главных направлений использования кислотных оксидов металлов является производство катализаторов. Катализаторы на основе кислотных оксидов металлов используются в химической промышленности для активации и ускорения химических реакций. Они играют ключевую роль в процессах синтеза органических соединений, очистки газов и жидкостей, а также в производстве пластмасс, лекарственных препаратов и других продуктов.
Другим важным применением кислотных оксидов металлов является использование их в качестве красителей и пигментов. Некоторые кислотные оксиды металлов обладают яркой окраской, что позволяет им использоваться в производстве различных красок, лаков, керамических и стеклянных изделий. Они придают продуктам насыщенные и устойчивые цвета, что делает их более привлекательными и эстетически приятными.
Важным применением кислотных оксидов металлов является их использование в электронной промышленности. Многие кислотные оксиды металлов являются полупроводниками или имеют другие полезные электронные свойства. Они применяются в производстве электронных компонентов, таких как транзисторы, диоды, интегральные схемы и другие электронные устройства. Благодаря своим уникальным свойствам, они позволяют создавать малогабаритные и высокопроизводительные устройства.
Также кислотные оксиды металлов широко применяются в производстве стекла, керамики, катализаторов для автомобильных выхлопных газов, аккумуляторов, солнечных батарей и многих других продуктов. Их использование в промышленности способствует повышению эффективности процессов, снижению затрат и созданию новых технологий и продуктов.
Опасность кислотных оксидов металлов для здоровья человека:

Кислотные оксиды металлов могут представлять серьезную опасность для здоровья человека. Взаимодействие этих веществ с организмом может вызывать различные негативные последствия, от легких раздражений до серьезных отравлений и даже смерти.
Опасность кислотных оксидов металлов обусловлена их высокой реактивностью и способностью образовывать кислотные растворы при контакте с водой. Эти растворы могут вызывать ожоги кожи и слизистых оболочек, а также вдыхание или проглатывание могут вызывать различные отравления.
При длительном воздействии кислотных оксидов металлов на организм человека могут возникать хронические заболевания, такие как респираторные проблемы, повреждения печени и почек, а также нарушения нервной системы. Некоторые из этих оксидов также могут быть канцерогенными и вызывать онкологические заболевания.
Важно соблюдать предосторожность при работе с кислотными оксидами металлов, использовать средства индивидуальной защиты, такие как респираторы, защитные очки и перчатки. При появлении каких-либо признаков отравления или раздражения, необходимо немедленно обратиться к врачу и прекратить работу с этими веществами.
Меры предосторожности при работе с кислотными оксидами металлов:

Работа с кислотными оксидами металлов требует особых мер предосторожности, так как они являются химическими веществами, обладающими высокой активностью и опасными свойствами.
Перед началом работы необходимо обязательно ознакомиться с техническими характеристиками и инструкцией по безопасному использованию каждого конкретного кислотного оксида. Это позволит избежать возможных несчастных случаев и минимизировать риск возникновения опасных ситуаций.
Одним из основных средств индивидуальной защиты при работе с кислотными оксидами металлов является защитная одежда. Она должна включать халат или комбинезон, резиновые или пластиковые перчатки, защитные очки или маску, специальные боты с нескользящими подошвами.
Работать с кислотными оксидами металлов следует только в хорошо проветриваемых помещениях или с использованием изолированных вытяжных систем. При значительном количестве вещества или возможности его испарения, необходимо использовать дыхательные аппараты с фильтрами для защиты от вдыхания вредных паров.
Важно помнить, что кислотные оксиды металлов являются коррозионно-активными веществами, поэтому необходимо предусмотреть меры по защите оборудования и инструментов от коррозии. После работы следует промыть инструменты и убрать их на место, а остатки оксидов должны быть аккуратно вымыты и утилизированы с соблюдением экологических требований.
Вопрос-ответ

Какие металлы образуют кислотные оксиды?
В качестве кислотных оксидов выступают оксиды неметаллов, образующие кислоты при реакции с водой. Кислотные оксиды металлов не существуют, так как металлы образуют основные оксиды.
Каковы свойства кислотных оксидов металлов?
Кислотные оксиды металлов не существуют, так как металлы образуют основные оксиды, которые реагируют с водой, образуя основания.
Какие еще бывают виды оксидов?
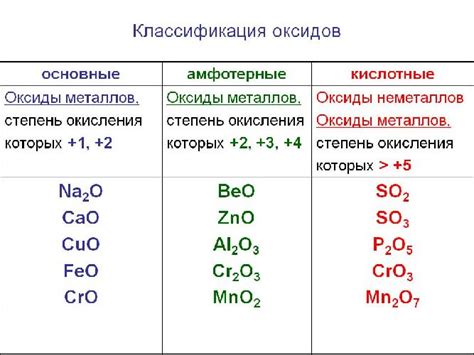
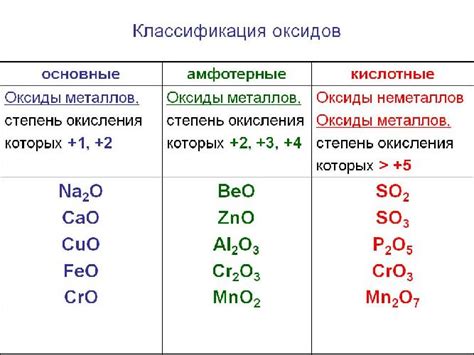
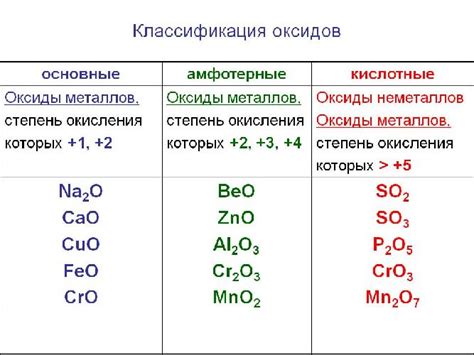
В зависимости от степени окисления элементов в соединении, оксиды могут быть кислотными, основными, амфотерными или нейтральными. Кислотные оксиды образуют кислоты при реакции с водой, основные оксиды - основания, амфотерные оксиды могут реагировать как с кислотами, так и с основаниями, а нейтральные оксиды не проявляют свойств кислот и оснований.
