Кислоты, оксиды, металлы, соли и вода - основные вещества, которые изучаются в химии. Каждое из этих веществ имеет свою уникальную формулу и обладает свойствами, которые определяют его химическую реактивность и влияние на окружающую среду.
Кислота - это химическое вещество, способное отдавать протоны (водородные ионы) в реакции. Основная формула кислоты имеет вид HX, где H - атом водорода, X - атом или группа атомов других элементов, таких как кислород, сера или азот. Кислоты обладают кислотностью и могут вызывать коррозию металлов, реагировать с щелочами и образовывать соли.
Оксиды - это химические соединения, состоящие из атомов кислорода, связанных с атомами других элементов. Они обычно имеют формулу XO или X2O, где X - атом другого элемента, такого как металл или неметалл. Оксиды могут быть кислотными, основными или нейтральными в зависимости от их реакции с водой.
Металлы - это класс элементов, характеризующихся светящимся, жестким, пластичным и проводящими тепло и электричество свойствами. Они имеют благоприятные условия для реакций с кислотами и окислителями, часто образуя соли и выделяя водородный газ.
Соли - это химические соединения, образованные путем реакции кислоты и основания. Соли обычно имеют формулу MX, где M - металл, а X - атом другого элемента, такого как кислород, сера или неметалл. Соли являются ионными соединениями и часто образуют кристаллическую решетку.
Вода - это наиболее распространенное соединение на Земле, обладающее уникальными свойствами, такими как высокая теплоемкость и растворимость веществ. Вода играет важную роль в химических реакциях и является средой, в которой происходит большинство химических процессов.
Формула и свойства кислоты
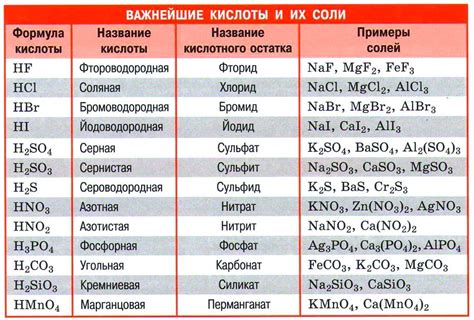
Кислоты - это вещества, обладающие кислотными свойствами. Они образуются при соединении водорода с неметаллами или гидроксидами металлов. Главной характеристикой кислоты является наличие в ее составе положительно заряженной водородной ионной группы (H+).
Формула кислоты может быть представлена в виде HX, где X - атом или группа атомов неметалла, соединившаяся с водородом. Некоторые кислоты имеют сложную формулу, включающую несколько атомов водорода и неметалла.
Кислоты обладают такими свойствами, как кислотность, реактивность и окрашивающая способность. Кислотность кислот определяется концентрацией ионов водорода в их растворе. Реактивность кислот проявляется в их способности вступать в химические реакции с основаниями, образуя соль и воду. Кроме того, кислоты могут окрашивать некоторые вещества в различные цвета.
Примерами кислот являются соляная кислота (HCl), серная кислота (H2SO4), азотная кислота (HNO3) и другие. Они широко используются в промышленности, медицине и повседневной жизни. Понимание формулы и свойств кислот помогает в изучении их роли в химических процессах и применении в различных областях.
Происхождение и строение

Кислоты - это химические соединения, обладающие кислотными свойствами. Они образуются при соединении водорода с неметаллом или с ионом отрицательной зарядки. Кислоты могут быть органическими и неорганическими.
Молекулы кислот состоят из одного или нескольких атомов водорода, присоединенных к молекуле неметалла или к катиону, образованному основным металлом.
Важно отметить, что кислоты могут быть монобазными (содержащими одну кислотную группу), полибазными (содержащими несколько кислотных групп) или амфотерными (обладающими как кислотными, так и основными свойствами).
Оксиды - это химические соединения, образованные при соединении кислорода с другим элементом. Они могут быть простыми (содержащими только кислород) или сложными (содержащими несколько остальных элементов). Оксиды могут быть кислотными, основными или нейтральными.
Оксиды обладают определенной регулярной структурой. Они состоят из атомов кислорода, которые могут быть связаны с атомами других элементов через ковалентную или ионную связь. Структура оксидов может быть кристаллической или аморфной.
Металлы - это химические элементы с характерными физическими и химическими свойствами. Они обладают высокой теплопроводностью, электропроводностью и блеском. Металлы могут иметь различные строение - кристаллическое или аморфное. Кристаллические металлы состоят из регулярной решетки атомов, а аморфные металлы имеют беспорядочную структуру.
Соли - это химические соединения, образованные при реакции кислоты и основания. Они состоят из ионов катиона и аниона. Соли могут быть кристаллическими или аморфными. Кристаллические соли имеют регулярную решетку ионов, а аморфные соли имеют более беспорядочную и неправильную структуру.
Вода - это химическое соединение, состоящее из двух атомов водорода и одного атома кислорода. Вода имеет простую и однородную структуру. Молекулы воды связаны между собой водородной связью. Вода может существовать в трех агрегатных состояниях - жидком, твердом и газообразном.
Свойства и классификация
Кислоты - это вещества, которые способны отдавать протоны в растворе и образовывать положительные ионы водорода. Они обладают кислым вкусом, изменяют цвет индикаторов и реагируют с некоторыми металлами, образуя соли и выделяя газ водород. Кислоты могут быть минеральными (содержащими один или несколько атомов водорода, соединенных с атомами одного или разных элементов) и органическими (содержащими один или несколько органических остатков).
Оксиды - это бинарные химические соединения, состоящие из кислорода и другого элемента. Они могут быть основными (образуют щелочные растворы при взаимодействии с водой) или амфотерными (реагируют и с кислородом, и с основаниями). Оксиды обладают сильными окислительными или восстановительными свойствами, а их растворы меняют окраску индикаторов.
Металлы - это элементы, которые обладают блеском, прочностью, хорошей теплопроводностью и электропроводностью. Они сильно реагируют с кислотами, образуя соли и выделяя водородный газ. Металлы могут быть разделены на активные, полуактивные и инертные в зависимости от их химической активности.
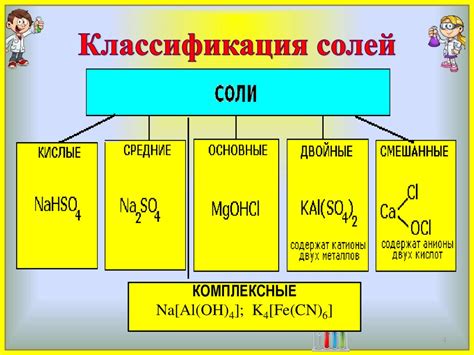
Соли - это химические соединения, образуемые в результате реакции металла с кислотой или основания с кислотой. Они обладают кристаллической структурой и хорошо растворяются в воде. Соли могут быть нормальными (содержащими один кислотный и один основной остаток), кислыми (содержащими один кислотный и два или более основных остатка) или основными (содержащими один основной и два или более кислотных остатка).
Вода - это химическое соединение, состоящее из атомов кислорода и водорода. Она обладает особыми свойствами, такими как высокая теплоемкость, растворимость различных веществ, хорошая растворимость и электропроводность. Вода играет важную роль во многих химических реакциях, является растворителем для многих веществ и основным компонентом клеточных и межклеточных жидкостей.
Формула и свойства оксида

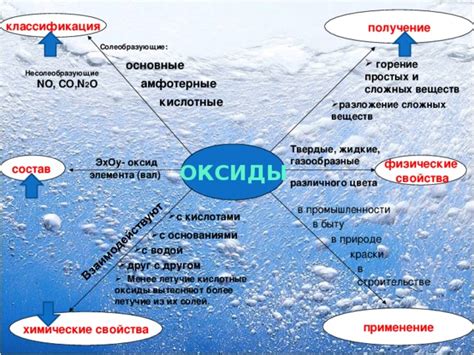
Оксид - это химическое соединение, состоящее из кислорода и другого элемента. Оксиды могут быть образованы различными элементами, такими как металлы, неметаллы или полуметаллы.
Формула оксида обычно записывается с помощью химических символов элементов, участвующих в соединении. Например, оксид кальция записывается как CaO, а оксид азота (II) как NO.
Оксиды обладают рядом характерных свойств, которые определяют их поведение и связывают их с другими веществами. Например, оксиды металлов обычно являются основаниями, то есть они образуют гидроксиды при реакции с водой. Оксиды неметаллов, напротив, часто взаимодействуют с водой, образуя кислоты.
Оксиды также могут демонстрировать различные свойства в зависимости от вида элемента, с которым они соединяются. Например, оксиды железа могут быть как оксидами с преобладанием трехвалентного железа (Fe2O3), так и двухвалентного (FeO). Каждый из таких оксидов обладает своими уникальными свойствами.
Важно отметить более сложные соединения, которые могут включать несколько оксидных групп. Например, сернокислый ангидрид (SO3) является соединением, состоящим из двух оксидных групп. Он может реагировать с водой, образуя серную кислоту.
Свойства оксидов являются одной из основных тем в изучении химии и играют важную роль в промышленности, медицине и других областях науки и техники.
Оксиды в природе и промышленности
Оксиды представляют собой химические соединения, состоящие из двух элементов, где кислород играет роль связующего атома. В природе оксиды широко распространены и составляют значительную часть Земной коры. Они образуются в результате взаимодействия элементов с кислородом в атмосфере, водах и почве. Многие оксиды обладают определенными физическими и химическими свойствами, которые используются человеком в промышленности.
Оксиды играют важную роль в промышленных процессах, включая получение металлов, производство стекла и керамики, полупроводниковые технологии и другие процессы. Например, оксид алюминия, известный как глина, используется для производства керамики и огнеупорных материалов. Оксид железа, или ржавчины, широко применяется в производстве стали и других металлических материалов.
Некоторые оксиды, такие как диоксид углерода (угарный газ) и оксид серы, являются вредными выбросами промышленности и автотранспорта. Они в значительной степени способствуют загрязнению атмосферы и приводят к образованию кислотных дождей. В то же время, некоторые оксиды, например оксид азота, применяются в качестве катализаторов в процессах производства азотной кислоты и других химических соединений.
Таким образом, оксиды играют важную роль как в природе, так и в промышленности. Они являются неотъемлемой частью многих химических процессов и в большинстве случаев оказывают значительное влияние на окружающую среду. Поэтому важно учитывать и контролировать их использование и выбросы для предотвращения негативного воздействия на окружающую среду и здоровье человека.
Свойства и реакции оксидов
Оксиды - это соединения элементов с кислородом. Они обладают различными физическими и химическими свойствами, которые определяют их важную роль в природе и в промышленных процессах.
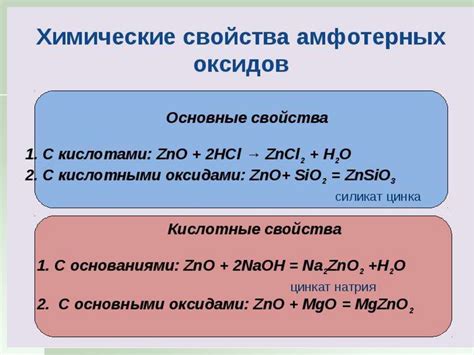
Одно из основных свойств оксидов - их кислотность или щелочность. Некоторые оксиды образуют кислотные растворы, когда растворяются в воде. Они реагируют с водой, образуя кислоты и высвобождая большое количество тепла. Другие оксиды, наоборот, образуют щелочные растворы, когда растворяются в воде. Они реагируют с водой, образуя щелочи и выделяя тепло.
Оксиды также обладают способностью реагировать с кислотами и образовывать соединения, называемые солями. Эти реакции осуществляются при нагревании или при добавлении катализаторов. Результатом таких реакций являются соли и вода. Например, оксид серы и хлор взаимодействуют с кислотой соляной, образуя соль серную и соль хлористоводородную соответственно.
Оксиды также являются важными реагентами в химических процессах. Они могут служить окислителями или восстановителями. Например, оксиды металлов могут образовывать соли, когда реагируют с кислотами, а оксиды неметаллов могут служить сырьем для производства кислот. Оксиды также используются в процессе получения металлов из руды и в различных промышленных процессах, таких как производство стекла и керамики.
Таким образом, свойства и реакции оксидов обусловливают их важную роль в химии и промышленности. Они играют ключевую роль в процессе образования кислот, солей и воды, а также в процессе окисления и восстановления различных веществ.
Формула и свойства металла
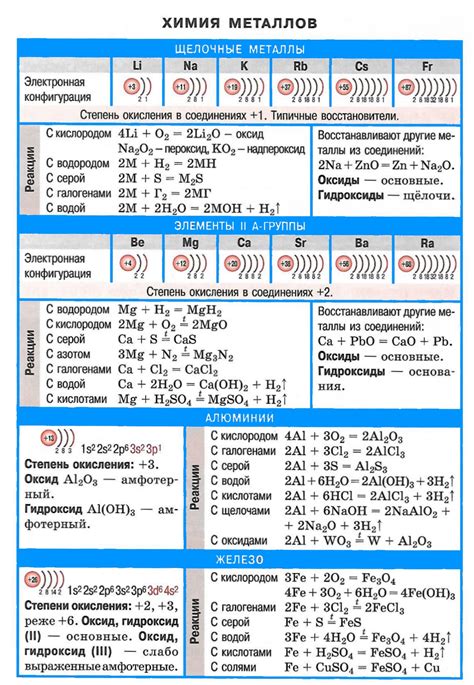
Металлы - это вещества, обладающие определенными химическими и физическими свойствами. Каждый металл имеет свою формулу, которая указывает на его состав и структуру. Формула металла обычно представляется символом химического элемента, например, Fe для железа или Cu для меди.
Металлы обладают рядом характерных свойств. Во-первых, они обладают высокой теплопроводностью, то есть способностью передавать тепло. Это свойство позволяет использовать металлы для производства термических устройств, таких как радиаторы или котлы.
Во-вторых, металлы обладают высокой электропроводностью, то есть способностью проводить электрический ток. Это свойство делает металлы идеальными материалами для производства проводов и электрических контактов.
Одним из главных свойств металлов является их способность образовывать ионы положительного заряда, которые называются катионами. Это объясняется наличием свободных электронов в кристаллической решетке металла. Благодаря своей положительной заряду, ионы металла способны взаимодействовать с отрицательно заряженными ионами или молекулами, образуя структуры, называемые солями.
Металлы также характеризуются высокой пластичностью и прочностью, что делает их подходящими для использования в различных конструкциях и механизмах. Они могут быть легко формованы и прочно держат свою форму даже при больших нагрузках.
Таким образом, формулы и свойства металла позволяют определить его состав и характеристики, что является ключевым для его использования в различных областях промышленности и производства.
Химический состав и структура

Кислота – это химическое вещество, состоящее из положительно заряженных водородных ионов (H+) и отрицательно заряженных кислотных радикалов. Кислота образуется в результате реакции оксида металла с водой или растворением газа в воде. Химическая формула кислоты содержит символы элементов и числовые индексы, причем сумма зарядов положительных и отрицательных ионов равна нулю. Кислоты обладают кислым вкусом и реагируют с металлами, оксидами и щелочами.
Оксид – это химическое соединение, состоящее из двух элементов, одним из которых обычно является кислород. Оксиды делятся на кислотные и основные, в зависимости от своих свойств. Кислотные оксиды соединяются с водой, образуя кислоты, а основные оксиды соединяются с водой, образуя щелочи. Химическая формула оксида содержит символы элементов и числовые индексы.
Металл – это химический элемент, обладающий блестящей поверхностью, хорошей электропроводностью и пластичностью. Металлы являются основными строительными материалами и используются во многих отраслях промышленности. Металлы могут образовывать оксиды, кислоты, соли и воду при взаимодействии с другими химическими веществами.
Соль – это химическое соединение, образованное в результате реакции кислоты и щелочи или металла. Соли обладают кристаллической структурой и обычно имеют высокую температуру плавления. Химическая формула соли содержит символы элементов и числовые индексы, причем сумма зарядов положительных и отрицательных ионов равна нулю. Соли используются в пищевой промышленности, медицине, сельском хозяйстве и других отраслях жизнедеятельности.
Вода – это химическое соединение, состоящее из двух атомов водорода (H) и одного атома кислорода (O). Вода является основным растворителем в природе и играет важную роль в жизнедеятельности всех организмов. Вода образуется в результате реакции горения, дыхания и других химических процессов. Формула воды – H2O, где числовой индекс 2 указывает на два атома водорода, а O – символ кислорода.
Термические и электрические свойства
Термические и электрические свойства веществ являются важными характеристиками, которые связаны с их способностью проводить тепло и электрический ток. Они дополняют химические свойства и позволяют лучше понять и классифицировать вещества.
Одно из основных термических свойств веществ - теплоемкость. Она характеризует количество теплоты, которое нужно передать веществу для повышения его температуры на определенную величину. Различные вещества имеют разные теплоемкости и это связано с их внутренней структурой и способностью молекул взаимодействовать друг с другом.
Кроме теплоемкости, важным термическим свойством является коэффициент теплопроводности. Он показывает способность вещества передавать тепло от одной его части к другой. Чем выше коэффициент теплопроводности, тем лучше вещество проводит тепло. Это свойство важно, например, для материалов, используемых в строительстве или технике, где нужно эффективно передавать или удерживать тепло.
Электрические свойства веществ связаны с их способностью проводить электрический ток. Одно из основных электрических свойств - электропроводность. Оно характеризует способность вещества переносить электрический заряд. Вещества, которые хорошо проводят электрический ток, называют проводниками. Напротив, вещества, которые плохо или вообще не проводят электричество, называют изоляторами.
Кроме проводников и изоляторов, существуют также полупроводники. Они обладают промежуточными свойствами и имеют возможность менять свою электропроводность под воздействием различных факторов, например, температуры или электрического поля. Именно благодаря этому полупроводники нашли широкое применение в электронике и соларных батареях.
Формула и свойства соли
Соль - это химическое вещество, образованное при реакции кислоты с основанием. Формула соли состоит из заряженных ионов, положительного ион - катиона и отрицательного иона - аниона.
Соли могут быть кислотными, основными и двойными. Кислотные соли образуются при реакции кислоты с металлом, основные соли - при реакции основания с кислотой, а двойные соли - при реакции двух солей.
Соли обладают рядом свойств. Они обычно обладают кристаллической структурой, которая может быть различной формы и цвета. Соли обычно имеют высокую температуру плавления и кипения, но легко растворяются в воде.
В растворе соли образуют ионизированные частицы, которые обеспечивают электролитическую проводимость. Это значит, что растворенные соли способны проводить электрический ток. Также соли обычно имеют хорошую растворимость в воде, но могут быть нерастворимыми в других растворителях.
Соли находят широкое применение в различных областях, включая пищевую промышленность, химическую промышленность, медицину и сельское хозяйство. Некоторые соли также используются в качестве пищевых добавок или консервантов.
Вопрос-ответ

Что такое кислоты?
Кислоты - это химические вещества, которые образуются при реакции некоторых веществ с водой. Они обладают кислыми свойствами, то есть способностью давать положительные ионы в растворе.
Какие есть виды кислот?
Существует несколько видов кислот, например, минеральные кислоты, органические кислоты и неорганические кислоты. Минеральные кислоты образуются при взаимодействии неметаллических оксидов с водой, органические кислоты содержат в своей молекуле углерод, а неорганические кислоты не содержат углерод.
Как записывается формула кислоты?
Формула кислоты обычно записывается в виде HₙX, где H - символ водорода, X - символ неметалла, а нижний индекс указывает на количество атомов водорода, образующих кислоту.
Какие свойства имеют соли?
Соли имеют свойства, характерные для ионных соединений. Они обладают хорошей растворимостью в воде, могут образовывать кристаллические структуры, проводить электрический ток в расплавленном или растворенном состоянии, а также иметь характерный цвет при образовании некоторых ионов.
Какими свойствами обладают металлы?
Металлы обладают несколькими характерными свойствами. Они могут быть хорошими проводниками электрического тока и тепла, обладают блеском и могут быть обработаны путем ковки и проката. Также металлы способны образовывать ионы положительного заряда и образовывать ионные соединения с кислотами.
