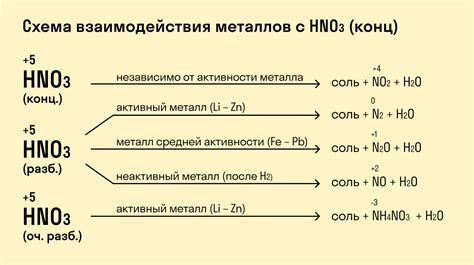
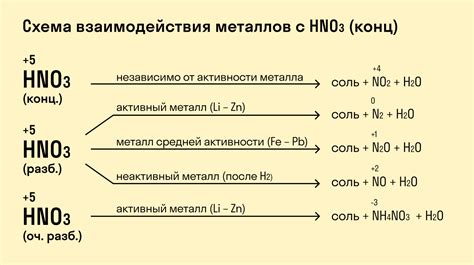
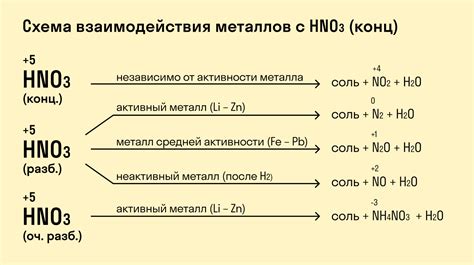
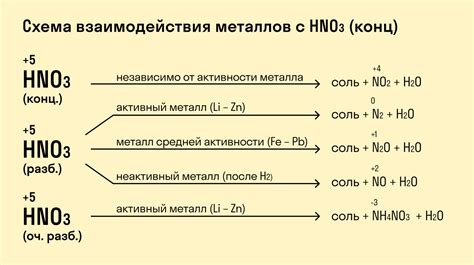
Реакция металлов с кислотой – явление, которое возникает при контакте металла с раствором кислоты. Металлы, расположенные левее водорода в электрохимическом ряду, проявляют активность при взаимодействии с кислотами. Они способны вытеснить водород из связи с кислородом и образовывать соли металлов и водородный газ.
Во время реакции металл сначала растворяется в кислоте, образуя ионы металла и водородные ионы. Затем ионы металла и ионы кислоты соединяются, образуя соль металла и выделяя молекулы водорода в виде пузырьков. Интенсивность реакции зависит от активности металла, концентрации кислоты и температуры.
Примером реакции металла с кислотой может служить реакция цинка с соляной кислотой. При этом образуется соль цинка – хлорид цинка – и выделяется водородный газ. Реакция протекает по следующему уравнению: Zn + 2HCl = ZnCl2 + H2.
Реакция металлов с кислотами имеет практическое применение. Например, обработка металлических поверхностей с помощью кислотного раствора позволяет удалить остатки оксидов и прочих загрязнений. Кроме того, реакция металлов с кислотами является важным этапом в процессе коррозии металлических материалов и исследовании их устойчивости к коррозии.
Свойства и реакция металлов с кислотами
Металлы являются химическими элементами, которые обладают рядом особых свойств, включая способность реагировать с кислотами. Реакция металлов с кислотами в результате взаимодействия происходит с образованием соли и выделением водорода.
Наиболее активные металлы, такие как литий, калий и натрий, реагируют с водородной кислотой сразу, образуя соль и выделяя водород. Они относятся к шестой группе таблицы Менделеева и называются щелочными или щелочноземельными металлами.
Однако, не все металлы реагируют с кислотами одинаково. Некоторые, такие как железо и цинк, могут реагировать только с сильными кислотами, такими как соляная или серная кислота. Другие металлы, например медь и серебро, не реагируют с кислотами вообще.
В реакции металлов с кислотами важную роль играет активность металла. Чем больше активность металла, тем более интенсивна и быстрая протекает реакция с кислотой. Это связано с тем, что активные металлы легко отдают электроны и образуют ионы металла, которые взаимодействуют с ионами кислоты, образуя соль.
Таким образом, реакция металлов с кислотами является важным явлением, которое используется в различных процессах и технологиях, включая производство солей и получение водорода.
Реакция левее расположенных металлов с водородной кислотой
Металлы, расположенные левее водорода в химической реактивности, обладают способностью взаимодействовать с водородной кислотой в более интенсивной и активной форме.
Под воздействием водородной кислоты, таких как соляная, серная или азотная кислоты, левее расположенные металлы проявляют гораздо более сильную реактивность по сравнению с водородом. Это связано с их способностью давать электроны, образуя положительно заряженные ионы металла в растворе.
- Натрий, калий и другие металлы первой группы периодической системы, которые относятся к активным металлам, реагируют с кислотой с выделением водорода и образованием соли.
- Магний, алюминий и другие металлы второй и третьей групп периодической системы имеют свойства активных ионов и также образуют соли с выделением водорода при реакции с кислотой.
Уровень активности этих металлов прямо зависит от их расположения в периодической системе элементов.
Реакция металлов с водородной кислотой может быть использована в различных химических процессах и технологиях, включая получение металлов из руд и производство химических соединений.
Как происходит взаимодействие металлов с растворами соляной кислоты

Взаимодействие металлов с растворами соляной кислоты является химической реакцией, в результате которой образуются соответствующие соли и выделяется водород. Некоторые металлы, в основном те, что расположены левее водорода в ряду активности металлов, проявляют высокую химическую активность и легко реагируют с соляной кислотой.
Когда металл погружают в раствор соляной кислоты, происходит ионизация кислоты, образование положительных и отрицательных ионов. Положительные ионы металла реагируют с отрицательными ионами соляной кислоты, образуя соли. В результате образования солей ионизированные водородные ионы соединяются, образуя молекулы водорода.
Реактивность металлов с соляной кислотой зависит от их электрохимического потенциала. Чем ниже потенциал металла, тем активнее он реагирует с кислотой. При реакции соляной кислоты с цинком образуется соль цинка и молекулы водорода, при этом реакция сопровождается выделением тепла и пузырьками газа.
Взаимодействие металлов с растворами соляной кислоты является одним из способов получения солей для промышленности. Кроме того, эта реакция имеет практическое применение в лабораторных исследованиях для определения активности металлов и поверхностного анализа веществ.
Влияние концентрации и температуры на реакцию металлов с кислотами
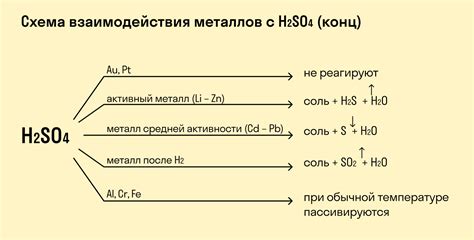
Реакция металлов с кислотами – важный процесс в химии, который может быть использован как для получения веществ, так и для анализа и исследования веществ. Особенно интересными являются реакции металлов, расположенных левее водорода в периодической системе, с кислотными растворами. При этом, концентрация и температура реакционной среды могут играть значительную роль в протекании реакции.
Концентрация кислоты оказывает влияние на скорость реакции металлов с кислотой. Повышение концентрации кислоты увеличивает скорость реакции. Это связано с тем, что повышение концентрации кислоты повышает реакционный потенциал, что ускоряет столкновения между металлом и кислотой. Таким образом, при более высокой концентрации кислоты реакция будет протекать быстрее.
Температура реакционной среды также имеет влияние на протекание реакции металлов с кислотами. Повышение температуры увеличивает скорость реакции. Это объясняется тем, что при повышении температуры возрастает энергия столкновения между металлом и кислотой, что способствует более активному протеканию реакции. Однако, при очень высоких температурах некоторые металлы могут образовывать пассивную оксидную пленку на своей поверхности, что может замедлить реакцию.
Таким образом, концентрация и температура реакционной среды играют важную роль в протекании реакции металлов с кислотами. Повышение концентрации кислоты и температуры способствует увеличению скорости реакции. Однако, необходимо учитывать, что экстремальные значения концентрации и температуры могут влиять на образование пассивной оксидной пленки и, как следствие, замедлить или остановить реакцию.
Сравнительные исследования реакции металлов с разными видами кислот
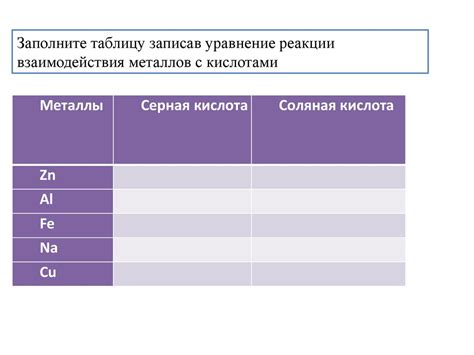
Металлы – одна из основных групп химических элементов, которые обладают хорошей проводимостью электричества и тепла, а также высокой химической активностью. Одним из способов проявления химической активности металлов является их реакция с различными видами кислот.
Сравнительные исследования реакции металлов с кислотами помогают определить их реакционную способность и проявление эффекта активности. В экспериментах можно использовать разные виды кислот, такие как соляная, уксусная, серная и др.
Реакция металлов левее водорода с кислотами протекает по общей схеме: металл вступает в реакцию с кислотой, образуя соль и выделяя водород. Температура реакции, скорость выделения водорода и характер образующейся соли могут отличаться в зависимости от металла и кислоты.
Некоторые металлы, такие как натрий, калий и цезий, сильно реагируют с кислотами, выделяя большое количество водорода. Другие металлы, например, железо и цинк, реагируют медленнее, образуя менее активные соли. Сравнительные исследования позволяют оценить степень активности каждого металла и его реакционную способность в отношении различных кислот.
Для удобства сравнения результатов исследований реакции металлов с кислотами можно составить таблицу, в которой указать металлы и соответствующие им кислоты, а также особенности реакции. Такая таблица поможет систематизировать полученные данные и сделать выводы о химической активности металлов в отношении кислот.
Теоретическое обоснование реакций металлов с кислотами

Реакция металлов с кислотами основана на протекании окислительно-восстановительных процессов, в результате которых происходит образование солей и выделение водорода. Металлы, расположенные левее водорода в химической активности, считаются активными металлами и реагируют с кислотами более интенсивно.
Природа реакции обусловлена способностью активного металла отдавать электроны и образовывать положительные ионы, а также способностью кислоты принимать электроны и образовывать отрицательные ионы. В процессе реакции металл отдаёт электроны кислоте, что приводит к образованию положительного иона металла и отрицательного иона кислоты.
Одним из ключевых факторов, влияющих на активность реакций металлов с кислотами, является электрохимический ряд, в котором металлы упорядочены по возрастанию активности. Металлы, стоящие левее водорода в этом ряду, обладают большей активностью и способны быстрее и интенсивнее реагировать с кислотами. Наиболее реактивные металлы, такие как натрий, калий и литий, могут даже реагировать с водой, образуя соответствующие оксиды и ионы гидроксида.
Таким образом, реакция металлов с кислотами определяется электрохимическими свойствами металла и кислоты, а также их взаимодействием на уровне обмена электронами и образования ионов. Активные металлы, расположенные левее водорода в электрохимическом ряду, обладают способностью реагировать с кислотами более энергично, образуя соли и выделяя водород.
Определение активности металлов по их реакции с кислотами
Реакция металлов с кислотами может служить хорошим индикатором их активности. Активность металла определяется его способностью образовывать ион в растворе и выделяться в виде газа при взаимодействии с кислотой. Чем выше активность металла, тем интенсивнее протекает его реакция с кислотой.
В ходе реакции металла с кислотой происходит образование соли и выделение водорода. При этом наблюдается характерное "шипение" или "шуршание", вызванное выделением пузырьков газа. Это явление происходит из-за того, что металл активнее водорода, и он вытесняет его из кислоты.
Чтобы определить активность металлов, можно провести серию экспериментов, в которых будут использоваться разные металлы взаимодействующие с одной и той же кислотой. По интенсивности выделения газа и скорости протекания реакции можно сделать вывод о степени активности каждого металла относительно других.
Первый шаг в проведении эксперимента - подготовка образца металла и кислоты. Затем металл помещается в реакционную посуду, а на него аккуратно добавляется кислота. Важно соблюдать осторожность при проведении эксперимента, так как реакция может протекать сильно, сопровождаясь выделением большого количества газа и возможным покалыванием.
Для удобства сравнения результатов эксперимента можно составить таблицу, в которой указать активность каждого металла в порядке возрастания или убывания, а также описать заметные особенности каждой реакции. Такой подход позволит получить наглядное представление об активности металлов и сделать выводы о их химических свойствах.
Применение реакции металлов с кислотами в химической промышленности
Реакция металлов с кислотами имеет широкое применение в химической промышленности. Открытие этой реакции лежит в основе многих процессов производства различных веществ и материалов.
Оксиды металлов, получаемые в результате реакции металлов с кислотами, являются важными сырьевыми компонентами для производства различных химических соединений. Например, оксид железа, получаемый при взаимодействии железа с кислородной кислотой, используется для производства железных сплавов, красителей и многих других продуктов.
Реакция металлов с кислотами также применяется для получения солей металлов. Эти соли используются как катализаторы в различных химических процессах, а также в производстве красителей, пестицидов и лекарственных препаратов.
Важным направлением применения реакции металлов с кислотами является электрогальваническое покрытие металлами. Процесс гальванизации, основанный на реакции металлов с кислотами, позволяет покрыть поверхность металлов слоем другого металла, что повышает их стойкость к коррозии и улучшает их внешний вид. Такие покрытия широко применяются в автомобильной и электронной промышленности.
Использование реакции металлов с кислотами в химической промышленности является одним из важных шагов в производстве различных продуктов. Эта реакция позволяет получить ценные продукты, которые имеют широкий спектр применения в различных отраслях промышленности.
Важность понимания реакции металлов с кислотами в химическом образовании

Реакция металлов с кислотами является одним из основных тем в изучении химии на уровне средней школы и вуза. Понимание этого процесса важно не только для успешной сдачи экзаменов, но и для понимания основ принципов химии и ее применения в реальной жизни.
Первоначально, реакция металлов с кислотами позволяет ученикам и студентам узнать общую химическую активность металлов и их отношение к кислотам. Успешное выполнение таких экспериментов требует соблюдения определенных мер предосторожности и умения работать с опасными веществами, что приобретает большое значение при изучении химической безопасности.
Кроме того, изучение реакции металлов с кислотами приводит к пониманию основного принципа образования солей и выделения водорода. Это помогает учащимся составлять уравнения реакций, определять продукты реакции и распознавать химические реакции в повседневной жизни.
Также, понимание реакции металлов с кислотами важно для абсолютно всех областей химии - от органической до неорганической. Это связано с тем, что металлы являются основными составными элементами многих химических реакций и играют важную роль в промышленности, медицине и экологии.
Наконец, понимание реакции металлов с кислотами способствует развитию критического мышления и умению анализировать экспериментальные данные. Учащиеся учатся сделать выводы на основе полученных результатов, а также представить свои идеи и предложения для дальнейшего исследования данной темы.
Вопрос-ответ

Какие металлы расположены левее водорода в периодической таблице?
Металлы, расположенные левее водорода в периодической таблице, включают литий, натрий, калий, рубидий, цезий и франций.
Чем обусловлена реакция металлов левее водорода с кислотой?
Реакция металлов, расположенных левее водорода в периодической таблице, с кислотой обусловлена их активностью. Эти металлы имеют низкую ионизационную энергию и высокую электроотрицательность, что позволяет им с легкостью отдавать электроны во время реакции с кислотой. Этот процесс сопровождается выделением водорода и образованием соли металла.
