Реакция кислоты с металлом и водородом является одной из самых знаковых реакций химии. При взаимодействии кислоты с металлом образуется соль, которая обладает определенными свойствами и может быть растворимой или нерастворимой в воде. Растворимая соль способна полностью диссоциировать в воде, образуя ионы, что делает ее хорошим проводником электрического тока.
Во время реакции кислота диссоциирует на ионы водорода и анионы, а металл, в свою очередь, окисляется и передает электроны водороду. В результате такой реакции образуется соль, состоящая из катионов металла и анионов кислоты. Если соль растворима в воде, то она диссоциирует на ионы, которые образуют ионные соединения с водой.
Образование растворимой соли при реакции кислоты с металлом и водородом имеет практическое применение. Например, в медицине растворимые соли используются как активные компоненты лекарственных препаратов, так как они обеспечивают быстрое и эффективное воздействие на организм. Кроме того, растворимые соли могут использоваться в процессе производства различных химических соединений и научных исследований.
Реакция кислоты с металлом и образование растворимой соли
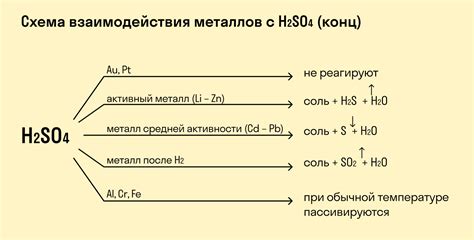
Реакция кислоты с металлом является основным примером реакции окисления-восстановления. В ходе данной реакции происходит образование растворимой соли, водорода и сопутствующего вещества. Кислота реагирует с металлом, вытесняя его из соединения и образуя новое соединение в виде соли.
Реакция между кислотой и металлом происходит при их контакте в присутствии воды. Кислота вытесняет металл из его соединения, образуя соответствующую соль. В ходе этой реакции происходит выделение водорода, который может быть замечен в виде пузырьков газа.
Возможность образования растворимой соли при реакции кислоты с металлом зависит от свойств кислоты и металла. Некоторые металлы, такие как железо, цинк и алюминий, реагируют с кислотами, образуя растворимые соли. Другие металлы, такие как золото и платина, не реагируют с кислотами и не образуют растворимых солей.
Реакция кислоты с металлом и образование растворимой соли являются важной химической реакцией, которая часто используется в лаборатории для исследования свойств различных кислот и металлов. Эта реакция имеет широкое применение в различных областях, включая промышленность, медицину и экологию.
Как металлы реагируют с кислотой
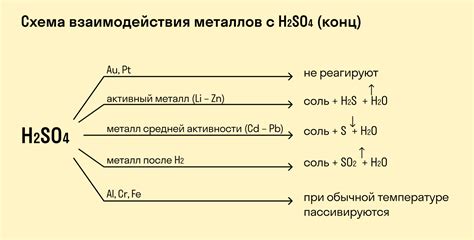
Реакция металлов с кислотами — один из важных процессов в химии, который приводит к образованию солей и выделению водорода. Когда металл взаимодействует с кислотой, происходит окислительно-восстановительная реакция, при которой металл окисляется, а кислота восстанавливается.
Реакция металлов с кислотой может проходить в различной интенсивности в зависимости от свойств металла и кислоты. Некоторые металлы, такие как натрий, калий и магний, реагируют с кислотами очень активно, освобождая большое количество водорода и образуя соли с характерными свойствами.
Один из способов визуализировать реакцию металлов с кислотой — использование газообразных продуктов, таких как водород. Водород выделяется в виде мелких пузырьков, возникающих на поверхности металла, который погружен в кислоту. Выделение водорода является признаком химической реакции и позволяет наблюдать ее характеристики, такие как скорость и интенсивность.
В реакции металлов с кислотой также образуются соли, которые обладают специфическими свойствами. Например, соль меди, получаемая путем реакции меди с кислотой серной, имеет сине-зеленый цвет и используется в химической промышленности и в других областях.
Таблица ниже представлена группа металлов и их реакционная способность с разными кислотами:
| Металл | Кислоты | Реакционная способность |
|---|---|---|
| Натрий | Серная | Сильно активная |
| Цинк | Уксусная | Умеренно активная |
| Серебро | Нитратная | Незначительная |
Реакция металлов с кислотой имеет множество практических применений, таких как получение солей, использование водорода в различных химических процессах и даже в процессах генерации энергии.
Свойства растворимых солей
Соль - это химическое соединение, состоящее из положительных и отрицательных ионов, которые разделяются в водном растворе. Растворимые соли обладают рядом свойств, которые делают их полезными и широко используемыми в различных областях.
Одно из основных свойств растворимых солей - способность генерировать электролитические растворы. Вода, в которой растворена соль, становится проводником электричества, так как положительные и отрицательные ионы соли диссоциируют и перемещаются в растворе. Это свойство используется, например, при производстве электролитов для аккумуляторов и батарей.
Другое важное свойство растворимых солей - способность изменять pH раствора. Некоторые соли могут образовывать кислые или щелочные растворы при диссоциации ионов. Например, соляная кислота (HCl) и хлорид натрия (NaCl) образуют кислотный раствор, а гидроксид натрия (NaOH) образует щелочной раствор. Это свойство солей используется в химической промышленности и в медицине для регулирования pH.
Растворимые соли также могут иметь свойства окрашивания. Некоторые соли металлов имеют способность образовывать окрашенные ионы, которые могут придавать раствору или твердой соли определенный цвет. Это свойство используется в производстве красителей, красок, пищевых добавок и в других областях.
Большинство растворимых солей обладают также определенной степенью термостабильности и стойкости к окружающим условиям. Они могут выдерживать высокие температуры, остаться стабильными в агрессивных средах или не деградировать при длительном хранении. Это свойство делает растворимые соли незаменимыми в промышленности, в частности в производстве керамики, электроники и других материалов.
Влияние металлической составляющей на свойства растворимых солей

Металлическая составляющая в реакции кислоты с металлом и водородом играет ключевую роль в формировании свойств растворимых солей. Особенности металла, его химические свойства и электрохимический потенциал определяют состав и растворимость образующихся солей.
Величина электрохимического потенциала металла является основным показателем активности металла и определяет его склонность к реакции с кислотой. Чем выше значение потенциала, тем более активным считается металл. Активные металлы, такие как натрий, калий или магний, реагируют с кислотами с образованием солей, при этом выделяется водород.
Металлическая составляющая также влияет на растворимость образовавшейся соли. Некоторые металлы образуют соли, которые хорошо растворяются в воде и образуют стабильные растворы. Другие металлы образуют соли, которые плохо растворяются и образуют нестабильные растворы. Это обусловлено различной поларностью и размерами ионов металла, а также наличием сложных ионных связей.
Растворимость солей может быть также ограничена пределами насыщения растворов. При насыщенном растворении некоторые соли могут образовывать осадок, являясь малорастворимыми. Например, соли некоторых металлов, таких как серебро, ртуть или свинец, образуют малорастворимые соли, которые выпадают в осадок при превышении их концентрации в растворе. Это явление широко используется в химических анализах для выделения металлов из растворов.
Таким образом, металлическая составляющая реагента имеет существенное влияние на свойства растворимых солей, определяя их состав, растворимость и стабильность. Этот фактор необходимо учитывать при изучении химических реакций и применении солей для различных целей, как в лаборатории, так и в промышленности.
Примеры образования растворимых солей при реакции металла с кислотой

1. Реакция натрия с соляной кислотой:
При взаимодействии натрия с соляной кислотой образуется соль - хлорид натрия (NaCl). Реакция происходит с выделением водорода и ионизацией натрия:
- 2HCl + 2Na → 2NaCl + H2
- Na → Na+ + e-
- e- + H+ → 1/2H2
2. Реакция цинка с серной кислотой:
Реакция цинка с серной кислотой приводит к образованию соли - сульфата цинка (ZnSO4). В результате реакции выделяется водород, а цинк окисляется, образуя ион цинка:
- Zn + H2SO4 → ZnSO4 + H2
- Zn → Zn2+ + 2e-
- 2e- + 2H+ → H2
3. Реакция железа с азотной кислотой:
Реакция железа с азотной кислотой приводит к образованию соли - нитрата железа (Fe(NO3)3). В процессе реакции выделяется водород, а железо окисляется, образуя ионы железа:
- 8HNO3 + 2Fe → 2Fe(NO3)3 + 4H2O + NO↑
- Fe → Fe3+ + 3e-
- 3e- + 3H+ → 3/2H2
4. Реакция магния с уксусной кислотой:
Взаимодействие магния с уксусной кислотой приводит к образованию соли - ацетата магния (Mg(CH3COO)2). В результате реакции выделяется водород, а магний окисляется, образуя ионы магния:
- 2CH3COOH + Mg → Mg(CH3COO)2 + H2
- Mg → Mg2+ + 2e-
- 2e- + 2H+ → H2
Важность изучения реакции кислоты с металлом и образования растворимой соли

Реакция кислоты с металлом является одной из основных химических реакций, которую студенты изучают в химическом образовании. Это важно, потому что она позволяет понять, как происходят химические реакции между различными веществами и какие продукты образуются в результате.
При реакции кислоты с металлом обычно образуется растворимая соль. Соль представляет собой соединение металла с кислотой, при этом ионы металла замещают водородные ионы в кислоте. Реакция кислоты с металлом может происходить с различными кислотами, такими как соляная кислота, серная кислота или уксусная кислота.
- Изучение реакции кислоты с металлом и формирования растворимой соли позволяет студентам лучше понять химические процессы и механизмы реакций.
- Это помогает им развить умение предсказывать и описывать результаты химических реакций на основе знания ионного обмена.
- Изучение этой реакции также помогает студентам понять свойства, состав и структуру солей, которые являются важными компонентами многих химических соединений и материалов.
- Кроме того, изучение данной реакции и образования растворимой соли является основой для понимания других более сложных химических процессов, таких как окисление и восстановление, которые имеют широкое применение в различных областях науки и технологии.
Таким образом, изучение реакции кислоты с металлом и образования растворимой соли играет важную роль в формировании понимания химических принципов, развитии научного мышления и подготовке студентов к дальнейшим исследованиям и профессиональному успеху в области химии и связанных с ней дисциплин.
Какие металлы можно использовать для получения растворимых солей
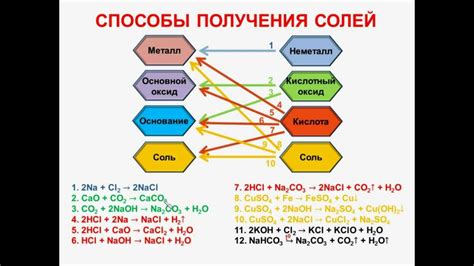
Растворимые соли могут быть получены путем реакции кислоты с различными металлами. Однако не все металлы могут быть использованы для этой цели. Некоторые металлы, такие как золото и платина, очень инертны и не реагируют с кислотами. Другие металлы, такие как калий и натрий, слишком реакционны и могут вызвать опасные реакции или взрывы.
Наиболее часто используются металлы из середины таблицы Менделеева - так называемый "избранная серия". Это включает металлы, такие как железо, цинк, медь и алюминий. Эти металлы реагируют с кислотами, образуя растворимые соли и высвобождая водород.
Металлы из середины таблицы Менделеева стали широко используемыми для получения растворимых солей из-за их относительной доступности и низкой стоимости. Они также обладают достаточной реакционной активностью, чтобы реагировать с кислотами, но не слишком реакционны, чтобы стать опасными.
Однако важно отметить, что каждый металл из середины таблицы Менделеева имеет свою специфическую реакционную активность и скорость реакции с кислотой. Например, цинк образует растворимые соли быстро и эффективно, в то время как медь образует соли медленнее и с меньшей эффективностью.
Вопрос-ответ

Какие вещества образуются при реакции кислоты с металлом и водородом?
В результате реакции кислоты с металлом образуется соль и выделяется водород. Например, при реакции соляной кислоты (HCl) с металлом цинком (Zn) образуется хлорид цинка (ZnCl2) и выделяется водородный газ (H2).
Как происходит реакция кислоты с металлом и водородом?
Реакция кислоты с металлом и водородом происходит с образованием соли и выделением водорода. Кислота отдает протоны металлу, образуя соответствующую соль, а водород выделяется в виде газа. Например, при реакции серной кислоты (H2SO4) с металлом железом (Fe) образуется сульфат железа (FeSO4) и выделяется водородный газ (H2).
