В химии существует ряд элементов, которые способны образовывать кислоты. Одним из таких элементов является металл. Интересно отметить, что кислоты, образованные металлом, находятся в периодической таблице правее водорода.
Водород имеет свойство образовывать кислоты с неметаллическими элементами, например хлором (HCl) или серной кислотой (H2SO4). Однако, когда металл образует кислоту, водород уже не присутствует в ее составе.
Металлические кислоты обладают различными свойствами и широко используются в промышленности и научных исследованиях. Они могут быть использованы в качестве катализаторов, растворителей, а также в процессе производства различных химических соединений и материалов.
Таким образом, изучение кислот, образуемых металлом, имеет большое значение для химической науки и промышленности. Понимание их свойств и возможностей открывает новые перспективы для разработки новых материалов и технологий.
Что такое кислота металл правее водорода?
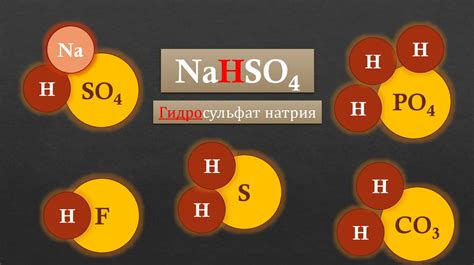
Кислота металл правее водорода - это физико-химическое явление, которое проявляется в реакции металла с кислотой, при которой металл вытесняет водород из своих соединений. Такая реакция носит ионный характер и протекает на принципе электрохимической активности веществ.
При взаимодействии металла со сильной кислотой, происходит разложение кислоты с выделением водорода и образованием соли металла. Это объясняется тем, что металлы обладают большей электрохимической активностью по сравнению с водородом, поэтому они имеют большую способность вытеснять водород из соединений.
Кислота металл правее водорода имеет широкое применение в химической промышленности и науке. Она используется для получения металлических солей, которые являются важными компонентами в различных производственных процессах. Кроме того, такие реакции имеют значение в аналитической химии и позволяют определить активность металлов и их способность взаимодействовать с кислотами.
Важно отметить, что в данном контексте кислота металл правее водорода означает не только химическую реакцию, но и показывает электрохимическую активность веществ. Такие знания помогают в понимании принципов химических реакций и могут быть применены в различных областях, связанных с химией и материаловедением.
Определение и свойства

Кислота металл правее водорода - это закономерность химических реакций, в которых кислота образует с металлом соль, выделяя водород. Закон доказывает, что металл находится в реактивной форме и больше активен, чем водород. Этот закон может быть применен для сравнения реактивности и противопоставления металлов и кислот в химических реакциях.
Кислота металл правее водорода имеет ряд характерных свойств. Во-первых, она способна с реактивными металлами образовывать соли, причем водород выделяется в газообразной форме, что делает реакцию заметной и позволяет легко сравнить активность различных металлов.
Во-вторых, кислота металл правее водорода обычно обладает более высокой реактивностью по сравнению с водородом. Это объясняется тем, что металлы активнее взаимодействуют с кислотой, чем с водородом, и готовы отдавать электроны, образуя положительные ионы.
Также следует отметить, что кислоты, которые находятся правее водорода, обычно образуют более летучие соединения с металлами. Это свойство можно применить при проведении аналитических методов, таких как гравиметрический и количественный анализ, для определения наличия и концентрации металлов в различных образцах.
Причины кислотности металлов

Кислотность металлов обусловлена рядом факторов, которые определяют химические свойства этих веществ. Одной из причин является способность металлов образовывать ионы положительного заряда, ионные радикалы, которые обладают выраженной активностью.
Другой причиной является высокая электроотрицательность некоторых металлов, таких как алюминий, железо, цинк. Их высокая электроотрицательность способствует образованию комплексных соединений с различными кислотами.
Ионизационная энергия металлов также играет роль в кислотности. Чем ниже ионизационная энергия, тем легче металл будет отдавать свои электроны при взаимодействии с кислотами.
Кроме того, кислотность металлов может быть связана с их способностью образовывать соединения с кислородом. Некоторые металлы, такие как алюминий и железо, могут образовывать оксиды, которые вступают в реакцию с водой, образуя кислотные растворы.
Также стоит отметить, что кислотность металлов может изменяться в зависимости от условий – температуры, давления, концентрации кислоты и т.д. Влияние этих факторов может привести к изменению реакционной способности металлов и, соответственно, их кислотности.
Сравнение кислотности металлов и водорода

Кислотность веществ определяется их способностью отдавать протоны. В химии существует шкала кислотности, известная как ряд активности металлов. В этом ряду металлы располагаются по убыванию их способности отдавать электроны, а следовательно, и протоны.
Водород является непосредственным сравнением для металлов при определении их кислотности. Водород активнее всех обычных металлов, поэтому он рассматривается как стандарт для сравнения. Если металл способен вытеснить водород из кислоты, то он будет более активным металлом с более высокой кислотностью.
Из ряда активности металлов видно, что вещества, такие как натрий, калий или цезий, имеют более высокую кислотность, чем водород. Это означает, что они могут вытеснить водород из кислоты, например, соляной кислоты. Но с другой стороны, металлы, такие как серебро или золото, не могут вытеснить водород из кислоты, поэтому они считаются менее кислотными.
Также имеется ряд неметаллических элементов, которые могут быть растворены водой и образуют кислотные растворы. Некоторые из них, такие как фосфорная или серная кислоты, могут быть более кислотными, чем водород. Однако они не могут быть сравнены с металлами в контексте кислотности, так как они взаимодействуют с водой, а не с кислотами.
Таким образом, можно сделать вывод, что металлы, правее водорода в ряду активности, обладают более высокой кислотностью. Они способны вытеснить водород из кислот и образовывать соответствующие соли.
Кислоты и их использование в промышленности

Кислоты являются важными химическими соединениями, широко используемыми в промышленности. Они имеют широкий спектр применений и играют важную роль в различных процессах производства.
Одно из основных применений кислот в промышленности - это использование их в процессе обработки металлов. Многие металлы реагируют с кислотами, что позволяет очищать, обрабатывать и покрывать их защитными слоями.
Например, серная кислота широко используется в процессе очистки металлов от окислов и загрязнений. Она способна растворять окислы и помогает восстанавливать металлы к их первоначальному состоянию. Серная кислота также используется для производства удобрений, пластиков и взрывчатых веществ.
Фосфорная кислота также находит широкое применение в промышленности. Она используется в производстве удобрений, стекла, фармацевтических препаратов и многих других продуктов. Благодаря своим свойствам, фосфорная кислота способна повышать эффективность процессов производства и улучшать качество конечного продукта.
Другой пример - хлороводородная кислота, широко используемая в промышленности для обработки металлов, отчистки поверхностей и в процессе производства пластиков. Она является сильным растворителем и способна эффективно удалять загрязнения с металлических поверхностей.
В промышленности также широко используются азотная кислота, хлористоводородная кислота, ацетилсалициловая кислота и многие другие виды кислот. Каждая из них имеет свои уникальные свойства и применения, сделав их важными компонентами в процессах промышленного производства.
Таблицы и графики сравнения кислотности металлов и водорода
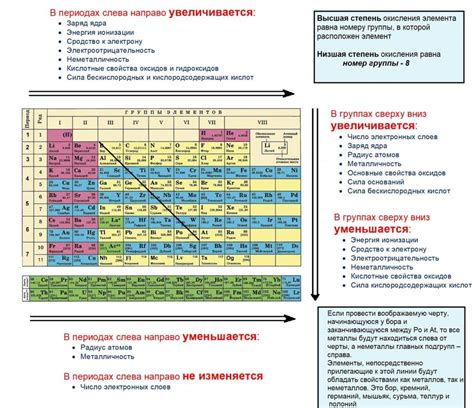
В химии существует понятие кислотности, которое отражает способность вещества отдавать водородные ионы. Когда рассматриваем кислотность металлов, можно сравнивать их со водородом. Это позволяет определить, является ли металл более или менее кислотным, чем водород. Для этой цели используются таблицы и графики.
Таблицы являются наглядным способом представления информации о кислотности металлов и водорода. В таблицах указывается ряд металлов, упорядоченных по их кислотности. Обычно металлы располагаются в порядке возрастания кислотности, где наиболее кислотным является первый металл, а наименее кислотным - последний.
Графики представляют собой визуальное отображение кислотности металлов и водорода. Ось x графика может показывать номер металла, а ось y - степень кислотности. График позволяет сравнивать различные металлы и водород по их кислотности. Чем выше точка на графике, тем более кислотный металл или водород.
Сравнение кислотности металлов и водорода с помощью таблиц и графиков - это эффективный способ визуализации информации. Он позволяет легко определить кислотность каждого металла и сравнить его с водородом. Эти инструменты помогают химикам и исследователям лучше понять свойства металлов и способствуют развитию науки.
Зависимость кислотности металлов от физических характеристик

Кислотность металлов зависит от их химических и физических характеристик. Физические свойства металлов, такие как электроотрицательность, размер атома, положение в периодической системе и электронная конфигурация, играют важную роль в определении степени их кислотности.
Один из факторов, влияющих на кислотность металлов, - их электроотрицательность. Чем выше электроотрицательность металла, тем сильнее он будет взаимодействовать с кислотами. Например, металлы такие как алюминий и цинк, имеющие низкую электроотрицательность, могут реагировать с кислотами только сильных кислот, таких как соляная кислота или серная кислота.
Размер атома также влияет на кислотность металлов. Чем меньше размер атома, тем легче ему проникать в реакцию с кислотой. Например, металлы с малым размером атома, такие как медь и железо, имеют большую кислотность и могут реагировать с широким спектром кислот.
Положение металлов в периодической системе также имеет значение. Металлы в левой части периодической системы, такие как литий и натрий, обладают наибольшей кислотностью, тогда как металлы справа, например, свинец и золото, имеют более низкую кислотность.
Электронная конфигурация металлов также определяет их кислотность. Металлы с полностью заполненными d- и f-субуровнями меньше склонны к реакции с кислотами, чем металлы с незаполненными d- и f-субуровнями. Например, металлы платиновой группы, такие как палладий и платина, обладают низкой кислотностью.
В целом, кислотность металлов зависит от их электроотрицательности, размера атома, положения в периодической системе и электронной конфигурации. Учет этих физических характеристик помогает понять, как металлы взаимодействуют с кислотами и какую реакцию они могут производить.
Выводы и перспективы исследований

Исследования, связанные с взаимодействием металлов с кислотами, имеют огромное значение для различных отраслей науки и промышленности. Полученные в ходе исследований результаты позволяют сделать ряд выводов.
Во-первых, эксперименты показали, что кислоты обладают разной реактивностью в контакте с различными металлами. Некоторые металлы могут активно взаимодействовать с кислотами, образуя соли и высвобождая водород, в то время как другие металлы меньше реактивны и могут быть устойчивы к воздействию кислотных растворов.
Во-вторых, исследования позволяют лучше понять основы химических реакций, происходящих при контакте кислот с металлами. Это позволяет разрабатывать новые методы синтеза соединений, а также улучшать существующие процессы в различных промышленных секторах.
Кроме того, исследования также дают возможность определить условия, при которых металлы могут быть надежно защищены от коррозии в кислотных средах. Это значительно важно для разработки новых материалов и специальных покрытий, которые могут сохранять свои свойства при контакте с кислотной средой.
Перспективы исследований в этой области включают разработку новых методов исследования взаимодействия кислот с металлами, а также поиск новых соединений и материалов, с использованием полученных знаний. Более глубокое понимание реакций кислот с металлами открывает широкие перспективы в области технологии и науки, что может привести к разработке новых материалов с улучшенными свойствами и повышенной устойчивостью к различным воздействиям.
Вопрос-ответ

Почему кислоты металлов правее водорода?
Кислоты металлов правее водорода из-за различия электроотрицательности металла и водорода. Водород имеет электроотрицательность 2,1, в то время как металлы имеют электроотрицательность менее 2,1. Поэтому при реакции металла с кислородом, образуется более полярная связь, чем при реакции водорода с кислородом. В результате, кислоты металлов обладают большей кислотностью и правее водорода в периодической таблице.
Какие металлы образуют кислоты правее водорода?
Кислоты, образуемые металлами правее водорода в периодической таблице, называются металлическими кислотами. К ним относятся, например, алюминий (Al), магний (Mg), цинк (Zn), железо (Fe) и другие.
Какие свойства имеют кислоты металлов?
Кислоты металлов обладают рядом характерных свойств. Они являются электролитами, то есть проводят электрический ток в растворе или плавленом состоянии. Кроме того, они реагируют с основаниями, образуя соли и воду. Они также обладают кислотными свойствами, проявляя агрессивное отношение к металлам и прочим неорганическим веществам.
Что приводит к образованию кислот металлов?
Образование кислот металлов обусловлено такими факторами, как электроотрицательность и размер атома металла. Металлы правее водорода в периодической таблице имеют меньшую электроотрицательность и обладают более маленькими атомами. Это позволяет им образовывать более полярные связи с кислородом и образовывать кислоты правее водорода.
Какие свойства имеет водород?
Водород – химический элемент, он неметаллический газ без цвета и запаха. Водород является самым легким из всех элементов и находится на левом верхнем углу периодической таблицы. Он имеет наименьшую электроотрицательность и может образовывать связи и с металлами, и с неметаллами. Водород также может образовывать воду с кислородом.
