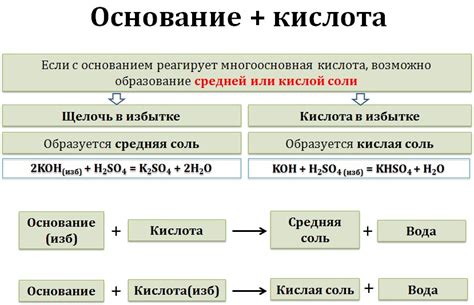
Кислота - это химическое вещество, обладающее кислотными свойствами. Они могут реагировать с различными веществами, включая металлы. В свою очередь, активные металлы - это группа химических элементов, которые способны образовывать ионы положительной заряды и участвовать в реакциях с другими веществами.
Когда кислота вступает в контакт с активным металлом, происходит химическая реакция, которая называется реакцией металла с кислотой. В результате этой реакции образуются соль и водород. Образование соли происходит благодаря обмену ионов между кислотными и металлическими частицами. Водород выделяется в виде газа.
Примером реакции кислоты с активным металлом является реакция соляной кислоты (HCl) с натрием (Na). В этой реакции натрий образует ион Na+, а кислота образует ион H+. Ионы Na+ и H+ обмениваются, образуя соль NaCl и выделяющийся газ водород (H2). Эта реакция может быть представлена следующим образом:
2HCl + 2Na → 2NaCl + H2
Что такое кислота и активный металл?
Кислота - это вещество, которое обладает кислотными свойствами и способно давать протоны или протонные акцепторы в реакциях. Кислоты могут быть органическими и неорганическими. Органические кислоты содержат кислород, а неорганические - не содержат.
Активный металл - это металл, который легко реагирует с другими веществами, включая кислоты. Активные металлы обладают высокой электроотрицательностью и могут образовывать электроположительные ионы.
Взаимодействие активного металла с кислотой происходит в результате обменной реакции, при которой активный металл вытесняет из кислоты водород. При этом образуется соль металла и выделяется водородный газ.
Некоторые примеры реакций активных металлов с кислотами:
- Реакция натрия с соляной кислотой: 2Na + 2HCl → 2NaCl + H2;
- Реакция калия с серной кислотой: 2K + H2SO4 → K2SO4 + H2;
В результате этих реакций образуются соли натрия и калия соответственно, а также выделяется водородный газ.
Взаимодействие кислоты и активного металла важно в химии и промышленности и находит применение во многих процессах, таких как производство водорода, синтез органических и неорганических соединений и других химических реакциях.
Характеристики активного металла
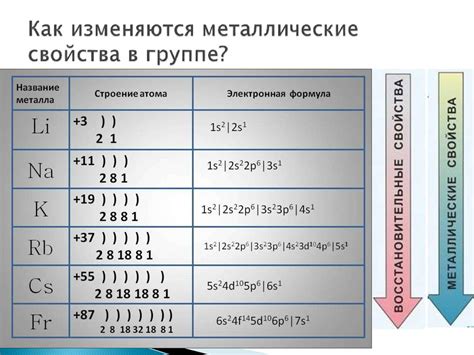
Активные металлы - это элементы, которые легко реагируют с кислотами и другими веществами, проявляя высокую химическую активность. Они обладают рядом характеристик, которые делают их особенно подходящими для взаимодействия с кислотами.
Во-первых, активные металлы имеют низкую ионизационную энергию, что означает, что они легко отдают свои электроны и образуют положительные ионы. Благодаря этому свойству они могут реагировать с кислотами, которые содержат отрицательно заряженные ионы, такие как ангидриды и гидроксиды. Например, натрий (Na) имеет низкую ионизационную энергию и активно реагирует с кислотами, образуя соль и выделяя водород.
Во-вторых, активные металлы обладают большими отрицательными потенциалами окисления, что делает их сильными восстановителями. Они способны передавать электроны другим веществам, включая кислоты. Примером может служить калий (K), который снижает окислительные свойства кислот и образует соответствующие соли.
Также активные металлы обычно имеют мягкую структуру и низкую плотность, что способствует их реакции с кислотами. Они легко растворяются в кислотах и образуют с ними ионные соединения.
Используя эти характеристики, активные металлы могут быть использованы в различных химических процессах и реакциях, таких как выработка водорода, производство солей и восстановление оксидацей кислорода в кислотах.
Характеристики кислоты
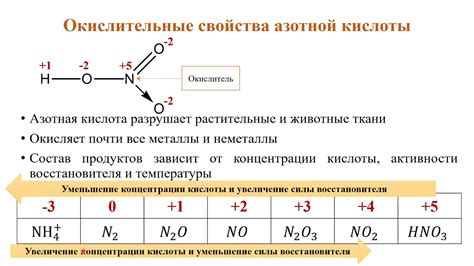
Кислота - это химическое соединение, которое обладает водородными ионообразующими свойствами. Одна из основных характеристик кислоты - ее способность отдавать водородные ионы (H+) при диссоциации в растворе.
Кислоты обладают кислым вкусом и способны изменять свойства других веществ при взаимодействии. Они могут проводить электрический ток, так как в растворе образуются ионы. Кислоты обладают коррозионными свойствами и могут реагировать с различными металлами, образуя соли и выделяя водород.
Одной из важных характеристик кислот является их кислотность, которая определяется концентрацией водородных ионов в растворе. Чем больше водородных ионов присутствует в растворе, тем больше концентрация и тем кислее кислота. Кислотность измеряется с помощью рН-шкалы, где значения ниже 7 указывают на кислотное окружение.
Кислоты также могут быть органическими и неорганическими. Органические кислоты, такие как уксусная кислота или лимонная кислота, содержат углерод в своей структуре. Неорганические кислоты, такие как хлороводородная или серная кислоты, не содержат углерод и образуются в результате реакции неорганических веществ.
Примеры реакций между кислотой и активным металлом
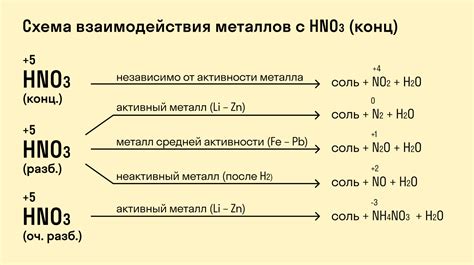
Реакции между кислотами и активными металлами представляют собой процессы, в которых активный металл реагирует с кислотой, образуя соль и выделяя газ. Кислоты делятся на неорганические (например, соляная или серная кислота) и органические (например, уксусная кислота).
Примером такой реакции может быть реакция между соляной кислотой (HCl) и металлом цинком (Zn). В результате реакции образуется соль цинка хлорида (ZnCl2), а также выделяется водородный газ (H2). Эта реакция может быть представлена следующим уравнением:
2 HCl + Zn → ZnCl2 + H2
Еще одним примером реакции между кислотой и активным металлом является реакция между серной кислотой (H2SO4) и металлом железом (Fe). В результате реакции образуется соль железа(II) сульфата (FeSO4), а также выделяется водородный газ (H2). Уравнение реакции будет иметь следующий вид:
H2SO4(конц) + Fe → FeSO4 + H2↑
Такие реакции играют важную роль в различных областях, включая химическую промышленность, в процессах производства солей и водорода, а также в химическом анализе.
Вопрос-ответ

Какие есть виды активных металлов?
Активные металлы подразделяются на две группы: щелочные металлы (например, натрий, калий) и щелочноземельные металлы (например, магний, кальций).
Что происходит при реакции активного металла с кислотой?
При реакции активного металла с кислотой образуется соль и выделяется водород. Это происходит из-за того, что активные металлы имеют способность замещать водород из кислоты.
