В химии кислород считается одним из наиболее активных элементов, и его взаимодействие с металлами обусловливает процессы окисления. Кислород является окислителем во многих реакциях, что означает, что он может получать электроны от другого вещества. Благодаря этому свойству, кислород способен превращать металлы в ионы и соединения с более высокой степенью окисления.
Когда металл вступает в реакцию с кислородом, электроны находятся в областях, которые могут быть затронуты кислородом, и эти электроны передаются кислороду. В результате металл окисляется, а кислород восстанавливается. Металл может образовать ионы или соединения с высокой степенью окисления, часто известные как оксиды металлов.
Реакции металлов с кислородом имеют широкое применение в промышленности и повседневной жизни. Например, окисление железа приводит к образованию ржавчины, что может привести к разрушению металлических конструкций. Однако некоторые металлы обладают способностью образовывать защитные оксидные слои, которые предотвращают дальнейшую коррозию.
Использование кислорода в реакциях с металлами играет важную роль в химической промышленности, например, при производстве стали или алюминия. Кроме того, понимание этих реакций и роли кислорода помогает разработать эффективные методы защиты от коррозии и других нежелательных процессов.
Феномен окисления в химии металлических реакций
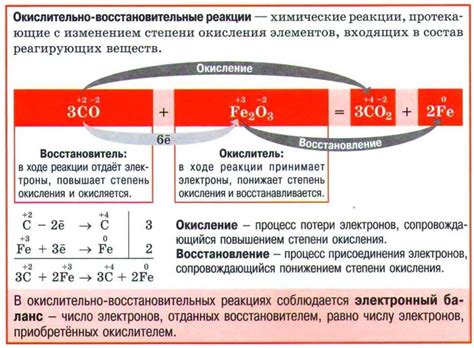
Феномен окисления играет важную роль в химических реакциях металлов. Окисление представляет собой процесс, при котором атомы или ионы металла теряют электроны и преобразуются в положительно заряженные ионы, называемые катионами. Этот процесс обычно происходит при взаимодействии металлов с кислородом.
Кислород входит в состав многих оксидов металлов, поэтому он является важным окислителем в химических реакциях с металлами. При окислении металлы передают электроны кислороду, что приводит к образованию оксидов металлов. В результате реакции металл становится окисленным, а кислород – восстановленным.
Процесс окисления металлов особенно активен в присутствии кислорода из воздуха. Реакция с кислородом обычно приводит к образованию оксидов металлов, таких как оксид железа (Fe2O3), оксид алюминия (Al2O3) и других.
Окисление металлов может иметь не только полезные, но и негативные последствия. Например, окисление железа приводит к образованию ржавчины, что снижает прочность и долговечность металлических конструкций. Однако, также существуют специальные покрытия и методы защиты, которые предотвращают окисление металлов.
В заключение, феномен окисления играет важную роль в химии металлических реакций. Окисление металлов в присутствии кислорода приводит к образованию оксидов металлов и изменению свойств материалов. Понимание этого феномена является важным для разработки новых материалов и технологий в области металлургии и материаловедения.
Кислород как активный элемент

Кислород — один из самых распространенных химических элементов в природе. Он проявляет активность при взаимодействии с другими элементами, включая металлы. Кислород обладает высокой электроотрицательностью, что делает его сильным окислителем в реакциях с металлами.
Взаимодействие кислорода с металлами приводит к образованию оксидов металлов. Эти оксиды могут быть как основными (базическими), так и кислотными. Основные оксиды образуются при реакции металла с кислородом в основной среде, например, при нагревании металла на воздухе. Кислотные оксиды формируются в присутствии кислорода в кислой среде.
Важно отметить, что активность кислорода взаимодействовать с металлами может зависеть от ряда факторов, включая электрохимический потенциал металла и условия окружающей среды. Некоторые металлы, такие как алюминий и титан, обладают высокой стабильностью оксидов и устойчивы к окислению кислородом.
Однако большинство металлов более или менее активно реагируют с кислородом, образуя оксиды. Реакция с кислородом может привести к образованию потерянных металлом электронов и образованию положительно заряженных ионов металла. Этот процесс известен как окисление металла и проявляется в образовании ржавчины, благодаря которой металл теряет свои свойства и прочность.
Прямое взаимодействие кислорода с металлами
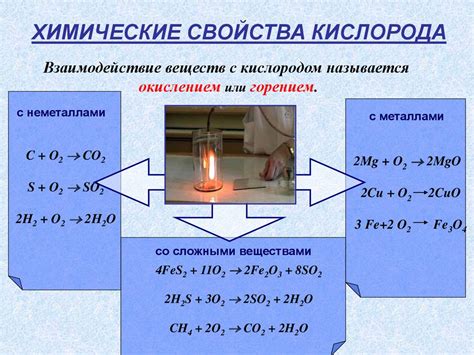
Прямое взаимодействие кислорода с металлами является основой многих химических реакций. Кислород обладает высокой электроотрицательностью и способен энергично реагировать с металлическими элементами, включая алкалии, щелочно-земельные металлы и многие переходные металлы.
Это взаимодействие обычно приводит к образованию оксидов металлов и осуществляется по реакции окисления, где кислород действует как окислитель. В результате образуются стабильные соединения, такие как оксиды, которые обладают различными физическими и химическими свойствами.
Прямое взаимодействие кислорода с металлами может происходить при нормальных условиях температуры и давления. Однако, для некоторых металлов, таких как литий, распространенными являются взаимодействия только при повышенных температурах. Это связано с тем, что взаимодействие с кислородом приводит к образованию окиси металла, которая является более устойчивой и предотвращает дальнейшую реакцию.
Прямое взаимодействие кислорода с металлами имеет широкий спектр применений. Оксиды металлов используются в качестве материалов для построек, катализаторов, пигментов, электродов и многих других областях. Более того, эти реакции являются фундаментальными в химии и играют важную роль в промышленности и научных исследованиях.
Образование оксидов и их свойства
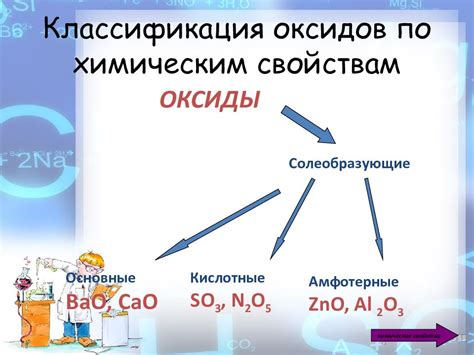
Оксиды представляют собой соединения, образующиеся в результате реакции металла с кислородом. Кислород выступает в этом процессе в качестве окислителя, при этом металл подвергается окислительной реакции. В результате реакции металл и кислород образуют химическое соединение, которое называется оксидом.
Свойства оксидов зависят от свойств металла, с которым они образуются. Некоторые оксиды обладают высокой химической активностью и способны реагировать с водой, образуя щелочи или кислоты. Например, оксид натрия Na2O взаимодействует с водой, образуя щелочь натрия NaOH. Оксид серы SO2 реагирует с водой, образуя сернистую кислоту H2SO3.
Другие оксиды обладают высокой степенью инертности и не проявляют химической активности. Например, оксид алюминия Al2O3 является инертным соединением, не реагирующим с водой или кислотами. Оксид магния MgO также обладает высокой степенью инертности и широко используется в промышленности.
Оксиды обычно имеют характерный кристаллический строение и обладают определенными физическими свойствами, такими как твердость, плотность, температура плавления и теплопроводность. Некоторые оксиды обладают способностью проводить электричество, из-за наличия свободно движущихся электронов в их структуре. Это делает их полупроводниками и находит применение в электронике и электротехнике.
Коррозия металлов под влиянием кислорода

Коррозия металлов является процессом разрушения материала под воздействием окружающей среды. Один из наиболее распространенных факторов, способствующих коррозии, является кислород. Кислород взаимодействует с металлом и вызывает образование оксидов металла.
Коррозия под влиянием кислорода происходит по двум основным механизмам: аэробная коррозия и электрохимическая коррозия. В случае аэробной коррозии, кислород из атмосферы взаимодействует с поверхностью металла и образует оксиды, такие как ржавчина и тарнация.
Электрохимическая коррозия также связана с действием кислорода на металл, но происходит при наличии электролита. В этом механизме, металл выступает в роли анода, а вода играет роль электролита. Кислород, растворенный в воде, окисляет металл, вызывая образование оксидов и древесной соли.
Одним из способов защиты от коррозии под воздействием кислорода является нанесение защитных покрытий на металлическую поверхность. Это может быть покрытие из пластмассы, краски, покрытия из цинка или хрома. Эти покрытия предотвращают прямое взаимодействие кислорода с металлом, защищая его от коррозии.
Также для предотвращения коррозии можно использовать антикоррозионные добавки, которые добавляются в металлы или пассивирующие средства, которые создают защитную пленку на поверхности металла. В результате использования таких методов коррозионные процессы под воздействием кислорода могут быть сведены к минимуму.
Влияние кислорода на химические процессы с металлами
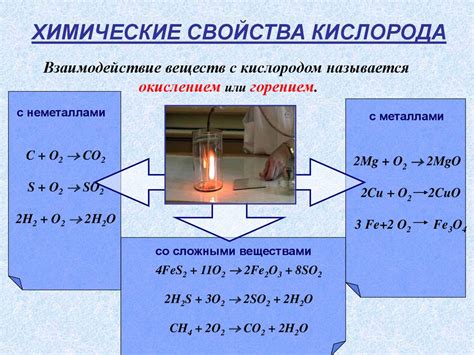
Кислород является одним из самых распространенных и важных элементов в химии. Он играет важную роль во многих химических процессах, включая реакции с металлами. Воздействие кислорода на металлы может значительно изменить их свойства и способность соединяться с другими элементами.
Одним из примеров реакций с металлами под воздействием кислорода является окисление. Кислород может вступать в реакцию с металлами, образуя оксиды. Эти оксиды могут быть как металлическими, так и неметаллическими соединениями, в зависимости от соотношения между кислородом и металлом.
Кислород также может выступать в роли окислителя при взаимодействии с металлами. В таких реакциях кислород получает электроны от металла и сам окисляется. Это может привести к образованию оксидов металла, где он имеет положительный степень окисления.
Помимо окисления, кислород может также приводить к образованию пероксидов и супероксидов, особенно при взаимодействии с более реактивными металлами. Например, пероксиды образуются при воздействии кислорода на щелочные металлы, а супероксиды - на щелочноземельные и некоторые другие металлы.
Кроме того, кислород может способствовать окислению металлов водой. При взаимодействии с металлом, кислород из воды может окислять металл, образуя окислы и выделяя при этом водород. Это проявляется в реакциях таких металлов, как натрий, калий и литий.
В целом, кислород играет важную роль в реакциях с металлами, изменяя их свойства и влияя на способность металлов соединяться с другими элементами. Изучение влияния кислорода на металлы помогает нам лучше понять и контролировать эти процессы, что имеет большое значение в различных областях, включая промышленность, энергетику и химическую науку в целом.
Кислород как важный фактор в железо-углеродном процессе
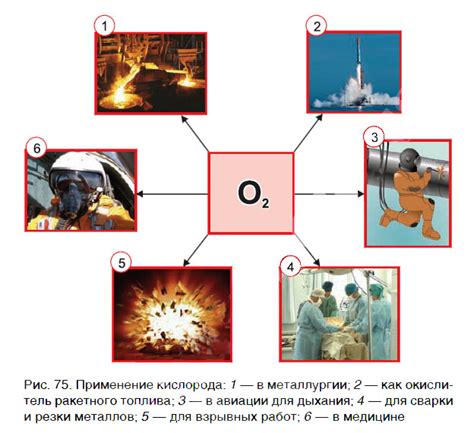
Железо-углеродный процесс представляет собой процесс получения стали из железной руды. Он является одним из наиболее важных процессов в металлургии и играет ключевую роль в производстве различных изделий из стали. Важным фактором в железо-углеродном процессе является кислород.
Кислород в железо-углеродном процессе выполняет функцию окислителя. Когда кислород вступает в реакцию с металлом, происходит окисление металла, что приводит к образованию оксида металла. При этом кислород переходит в двуокись углерода.
Кислород также играет важную роль в процессе нагревания металла. При обработке железной руды в металлический железо, необходимо нагревать сырье до высоких температур. Процесс нагревания осуществляется с помощью кислорода, который жжется в печи, производя высокотемпературные пламя. Высокие температуры необходимы для плавления металла и его превращения в жидкое состояние.
Таким образом, кислород является неотъемлемым компонентом в железо-углеродном процессе. Он выполняет две важные функции: окисление металла и обеспечение высоких температур для плавления металла. Без кислорода невозможно получить сталь из железной руды и производить различные изделия из стали.
Окислительные реакции и роль кислорода в промышленности

Кислород является мощным окислителем и играет важную роль во многих промышленных процессах. Окислительные реакции с кислородом широко применяются для получения различных продуктов и материалов. Один из основных примеров таких реакций - горение металлов.
В промышленности кислород используется для металлургических процессов, таких как обжиг металлических сплавов и производство стали. Кислород участвует в окислительно-восстановительных реакциях, где он окисляет металлы, способствуя их окислению. Это позволяет удалить примеси и получить чистый металл с высокой степенью чистоты и прочности.
Кроме того, кислород используется как окислитель в процессе окисления органических соединений. Это важный шаг в производстве различных органических соединений, таких как спирты, альдегиды и кислоты. Путем окисления органических веществ с использованием кислорода можно получить разные продукты с различными свойствами и химическими реакциями.
Другой пример использования кислорода в промышленности - процесс аэробного очистки сточных вод. Кислород применяется для поддержания жизнедеятельности аэробных бактерий, которые разлагают органические вещества в сточных водах и превращают их в более безопасные продукты. Кислород в данном случае обеспечивает необходимое условие для работы этих бактерий и повышает эффективность процесса очистки стоков.
Таким образом, кислород играет важную роль в промышленности, занимая место окислителя во многих реакциях. Его использование позволяет получать продукты высокой чистоты, эффективно очищать стоки и улучшать химические процессы в различных отраслях промышленности.
Вопрос-ответ

Для чего использование кислорода в реакциях с металлами?
Использование кислорода в реакциях с металлами позволяет проводить окислительные реакции, в результате которых металлы окисляются и образуют оксиды. Кислород является одним из наиболее активных окислителей и способен взаимодействовать с многими металлами, образуя стабильные оксиды.
Каким образом кислород действует на металлы?
Кислород действует на металлы путем окисления, то есть передачи электронов от металла к кислороду. В результате этого процесса металлы образуют положительные ионы, а кислород - отрицательные. Кислород является электроотрицательным элементом и обладает большой способностью притягивать электроны, поэтому может легко окислить металлы в соответствующие оксиды.
