Периоды элементов – это одна из основных классификаций элементов в химии. Они представляют собой ряды элементов, расположенных в одной горизонтальной строке таблицы Менделеева. Первый период состоит из двух элементов: водорода и гелия, а каждый следующий период добавляет по одному элементу. Всего в таблице Менделеева существует семь периодов, и каждый из них имеет свои особенности и характеристики.
Первый период таблицы Менделеева начинается с двух щелочных металлов – лития и натрия. Щелочные металлы отличаются высокой химической активностью и являются одними из самых реактивных элементов в таблице Менделеева. Второй период добавляет бериллий и так далее, поэтому периоды элементов представляют собой постепенное нарастание номинальных энергий орбиталей электронов в атоме.
Изучение периодов элементов позволяет нам лучше понять взаимодействие различных элементов и их свойства. Каждый период имеет свой уникальный химический символ, атомный номер и атомную массу. Таблица Менделеева стала незаменимым инструментом в химических исследованиях и применяется во многих областях науки и промышленности.
Щелочные металлы: особенности периодов
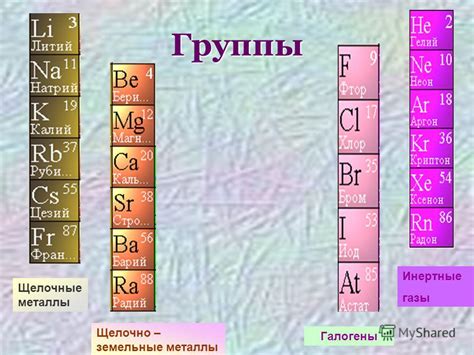
Щелочные металлы представляют собой группу элементов первой группы периодической системы, включающую литий, натрий, калий, рубидий, цезий и франций. Одной из особенностей этой группы является их положение в первом периоде таблицы.
Период – это горизонтальный ряд элементов в таблице Менделеева. Каждый период представляет собой одну энергетическую оболочку, на которой расположены электроны. Щелочные металлы находятся в первом периоде, что означает, что у них наиболее близкое расположение от ядра и наименьшие размеры атомов.
Состояние атомов щелочных металлов в первом периоде также связано с особенностями их электронной конфигурации. Все щелочные металлы имеют одно электронное состояние s1, то есть внешний электрон находится в s-орбитали. Это делает их очень реактивными и неустойчивыми.
В первом периоде таблицы Менделеева также присутствуют элементы других групп, такие как гелий, неон и аргон. Они относятся к инертным газам и имеют завершенные электронные орбитали. Взаимодействие щелочных металлов с инертными газами может привести к образованию химических связей и процессам, способствующих созданию стабильности.
Изучение периодов щелочных металлов позволяет понять особенности их свойств и реактивности. Кроме того, это помогает предсказать и объяснить реакции, происходящие при взаимодействии щелочных металлов с другими веществами.
Период 1: гидроген и гелий

Первый период периодической системы элементов включает всего два элемента - гидроген и гелий. Эти элементы имеют простую атомную структуру и играют важную роль в химии и физике.
Гидроген (H) - самый легкий элемент в периодической системе. В его атоме всего один протон и один электрон. Гидроген встречается в природе в виде газа и является одним из основных элементов, составляющих воду. Он широко используется в различных отраслях промышленности, включая производство аммиака, водорода и синтеза различных химических соединений.
Гелий (He) - второй элемент первого периода. Этот газ имеет более сложную атомную структуру, с двумя протонами и двумя нейтронами. Гелий обладает уникальными свойствами, такими как низкая плотность и высокая теплоемкость. Он широко используется в научных исследованиях, в промышленности для заполнения атмосферы воздушных шаров и в медицине, например, для охлаждения магнитного резонанса томографа.
Первый период элементов в периодической системе является основой для понимания структуры и свойств всех остальных элементов. Гидроген и гелий, хоть и самые простые элементы, играют важную роль в химических реакциях, физических процессах и приложениях в различных областях науки и промышленности.
Период 2: литий, натрий, калий, рубидий, цезий и франций
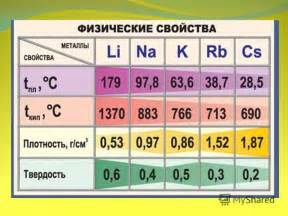
Второй период таблицы элементов, включает в себя шесть элементов: литий, натрий, калий, рубидий, цезий и франций. Все эти элементы относятся к группе щелочных металлов и обладают сходными свойствами.
Литий - первый элемент во втором периоде. Он находится в группе 1 и имеет атомный номер 3. Литий является легким металлом, который имеет низкую плотность и температуру плавления. Отличительной особенностью лития является его реакция с водой, при которой образуется горючий газ водород.
Натрий - второй элемент в этой группе с атомным номером 11. Натрий также является металлом, химически активным элементом. Он обладает низкой плотностью и низкой температурой плавления, что делает его полезным во многих промышленных процессах.
Калий - третий элемент периода 2. Он находится в группе 1 и имеет атомный номер 19. Калий также является металлом с низкой плотностью и низкой температурой плавления. Он широко используется в промышленности, в особенности в производстве удобрений.
Рубидий - четвертый элемент в этом периоде. Он находится в группе 1 и имеет атомный номер 37. Рубидий также является металлом, похожим на калий и натрий по своим свойствам. Он имеет низкую плотность и низкую температуру плавления.
Цезий - пятый элемент периода 2 с атомным номером 55. Цезий является металлом группы 1 и обладает схожими свойствами с другими щелочными металлами. Он имеет низкую плотность и очень низкую температуру плавления.
Франций - последний элемент во втором периоде. Он находится в группе 1 и имеет атомный номер 87. Франций - самый редкий и нестабильный элемент среди других элементов в этой группе. Он является радиоактивным и имеет очень короткое время жизни.
Вопрос-ответ

Какие еще элементы входят в периоды элементов, кроме щелочных металлов?
После щелочных металлов идут элементы, принадлежащие к группе переходных металлов, такие как железо (Fe), медь (Cu), никель (Ni) и титан (Ti). Через период заканчиваются элементы инертных газов, такие как гелий (He), неон (Ne), аргон (Ar) и криптон (Kr). Последние два периода периодической системы содержат многочисленные элементы с различными свойствами и расположенные в порядке возрастания атомного номера.
Для чего изучать периоды элементов и какую пользу это может принести?
Изучение периодов элементов имеет несколько важных целей. Во-первых, оно помогает понять структуру периодической системы и взаимосвязи между различными элементами. Во-вторых, изучение периодов может помочь установить закономерности и тренды в свойствах элементов, таких как реакционная способность, электроотрицательность и многие другие. Это важно для разработки новых материалов и технологий. Изучение периодов также может помочь ученым предсказывать свойства еще не открытых элементов и привлечь внимание к областям исследований, которые могут иметь практическую пользу.
