Диссоциация электролитов – процесс, при котором электролиты распадаются на положительно и отрицательно заряженные ионы в растворе. При этом катионы металлов являются одной из ключевых групп ионов, образующихся при диссоциации.
Катионы металлов характеризуются положительным зарядом и наличием недостатка электронов. Они обладают высокой химической активностью и способны образовывать различные соединения с отрицательно заряженными анионами.
Катионы металлов широко используются в различных областях, таких как химическая промышленность, металлургия, электроэнергетика и другие. Они играют важную роль в процессах коагуляции, флокуляции, электродефицитной цинковании и многих других.
Исследование катионов металлов позволяет получить информацию о свойствах их соединений, их взаимодействиях с другими веществами и их влиянии на окружающую среду и организмы живых организмов. Углубленное изучение катионов металлов имеет большое значение для разработки новых технологий и материалов, а также для решения проблем, связанных с загрязнением окружающей среды и охраной здоровья.
Свойства катионов металлов при диссоциации электролитов
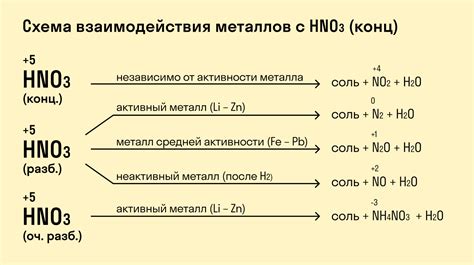
Катионы металлов, образующиеся при диссоциации электролитов, обладают рядом свойств, которые определяют их химическую активность и влияют на их взаимодействия с другими веществами.
Во-первых, катионы металлов имеют положительный заряд и привлекают отрицательно заряженные ионы или группы ионов. Это позволяет им участвовать в реакциях с анионами, образуя стабильные соединения.
Во-вторых, катионы металлов часто обладают высокой реакционной способностью из-за своей электронной структуры. Они могут участвовать в окислительно-восстановительных реакциях, передавая или принимая электроны.
Кроме того, катионы металлов могут образовывать комплексы с различными лигандами, то есть молекулами или ионами, которые связываются с катионами посредством химической связи. Это свойство позволяет им образовывать стабильные структуры и влиять на их растворимость и реакционную способность.
Некоторые катионы металлов также обладают свойствами катализаторов, то есть они способны ускорять химические реакции без изменения своей концентрации. Это делает их важными компонентами в различных процессах, таких как синтез химических соединений или очистка отходов.
Таким образом, свойства катионов металлов при диссоциации электролитов играют важную роль в химии и могут использоваться для контроля и управления химическими превращениями и реакциями.
Образование катионов металлов

Образование катионов металлов происходит при диссоциации электролитов в растворе. Электролиты - это вещества, способные в ионизированном состоянии проводить электрический ток.
Когда электролиты растворяются в воде, происходит процесс диссоциации, при котором они расщепляются на ионы. Металлы образуют положительные ионы, называемые катионами. Вода, в свою очередь, образует отрицательные ионы, или анионы.
Образование катионов металлов является следствием процесса окисления. Металлы имеют свойство отдавать электроны, поэтому они теряют одну или несколько электронов, превращаясь в положительно заряженные ионы. Электроны, которые металлы отдают, передаются анионам или использованы в реакциях с другими веществами.
Ионный состав раствора электролитов определяется концентрацией металлических катионов. Чем больше электролитов растворено в растворе, тем больше катионов металлов образуется. Это является основой для использования электролитов в различных процессах, таких как электролиз, гальваническая коррозия, гальваническое осаждение металлов и другие.
Физические свойства катионов металлов
Катионы металлов обладают рядом характеристических физических свойств. Во-первых, они обычно имеют положительный заряд, так как теряют один или несколько электронов при диссоциации электролитов. Это позволяет им притягиваться к отрицательно заряженным частицам, таким как анионы или молекулы воды.
Во-вторых, катионы металлов часто обладают большими размерами и массой по сравнению с атомами, из которых они образованы. Это связано с тем, что при потере электронов их электронные облака сжимаются, что делает их более компактными и тяжелыми.
Кроме того, некоторые катионы металлов обладают окрашивающими свойствами. Например, ионы железа приобретают зеленый или красно-коричневый цвет, ионы меди - синий или зеленый, а ионы хрома - желтый или оранжевый. Эти свойства определяют цветность растворов электролитов, содержащих данные катионы.
Другая важная характеристика катионов металлов - их способность образовывать комплексы с различными соединениями и молекулами. Комплексы катионов металлов широко используются в химической промышленности и лабораториях для различных целей, таких как катализ и синтез новых соединений.
Некоторые катионы металлов также обладают магнитными свойствами. К примеру, ионы железа и никеля являются магнитными и способны образовывать соединения с постоянным магнитным моментом. Это делает их полезными для создания магнитов и других устройств, которые используют магнитные свойства для работы или хранения информации.
В целом, физические свойства катионов металлов варьируются в зависимости от их структуры, заряда и окружающих условий. Они могут быть использованы в различных областях науки и промышленности благодаря своим уникальным химическим и физическим свойствам.
Вопрос-ответ

Какие металлы могут образовывать катионы при диссоциации электролитов?
Многие металлы могут образовывать катионы при диссоциации электролитов. Например, натрий, калий, магний, кальций, железо, алюминий и другие.
Каким образом происходит образование катионов при диссоциации электролитов?
При диссоциации электролитов, между положительно заряженным атомом металла и отрицательно заряженными ионами воды (гидроксид-ионы или другие), происходит образование ионной связи, в результате которой образуются катионы металлов.
Какую роль играют катионы металлов при диссоциации электролитов?
Катионы металлов являются основой электролитов и играют важную роль в реакциях диссоциации. Они обладают положительным зарядом и способны образовывать ионы в растворе, что позволяет проводить электрический ток и участвовать в различных химических процессах.
