Катализаторы играют важную роль в химических реакциях, ускоряя и направляя процесс. Они способны повышать скорость реакции, снижать энергию активации и улучшать выход продукта. В мире существует множество видов катализаторов, и одним из наиболее распространенных и важных классов являются металлические катализаторы.
Металлические катализаторы обладают высокой активностью и селективностью, что делает их идеальными для множества реакций. Они могут быть использованы в различных отраслях промышленности, включая производство пластмасс, лекарств, удобрений и топлива. Кроме того, металлические катализаторы могут быть использованы для очистки отходов и загрязнений в окружающей среде.
Существует несколько основных видов металлических катализаторов, включая платину, палладий, никель, железо, золото и многие другие. Каждый из этих металлов имеет свои уникальные свойства и способности к катализу, что делает их полезными для разных типов реакций. Например, платина часто используется для катализа окисления аммиака, палладий – для катализа водородации, а золото – для катализа окисления угарного газа.
Виды катализаторов: основные металлы

Катализаторы, содержащие основные металлы, являются важной составляющей в химической промышленности. Они играют важную роль в ускорении химических реакций и повышении эффективности процессов.
Одним из наиболее распространенных металлических катализаторов является платина. Этот драгоценный металл обладает высокой активностью и стабильностью, что делает его идеальным кандидатом для использования в различных реакциях. Например, платина может использоваться при производстве аммиака, гидрогенирования нефти и водорастворимых органических соединений.
Еще одним из основных металлов, широко используемым в качестве катализатора, является никель. Никельовые катализаторы применяются в реакциях гидрирования, окисления и конверсии. Они обладают высокой активностью и способностью эффективно протекать реакции при сравнительно низкой температуре.
Кроме платины и никеля, также широко используются катализаторы на основе металлов, таких как родий, иттрий, рутений и другие. Каждый из этих металлов имеет свои особенности и предназначение, что позволяет выбрать наиболее подходящий катализатор для конкретной химической реакции. Например, родийовые катализаторы часто используются в реакциях гидрирования, а рутений - в катализе окислительных процессов.
В целом, металлические катализаторы являются неотъемлемой частью химической промышленности. Их применение позволяет увеличить скорость реакции, снизить энергозатраты и повысить качество производимых продуктов. В будущем металлические катализаторы будут играть еще более важную роль в развитии новых технологий и процессов.
Платиновые катализаторы:
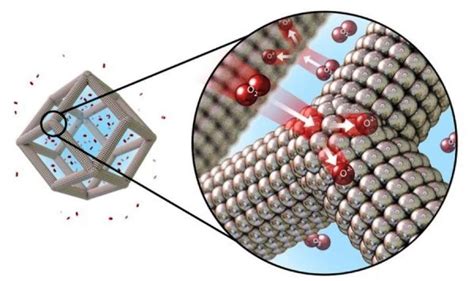
Платиновые катализаторы являются одними из самых эффективных катализаторов, используемых в промышленности. Платина является металлом с высокой каталитической активностью и стабильностью, что делает ее идеальным материалом для производства катализаторов.
Платиновые катализаторы широко применяются в химической промышленности для проведения различных каталитических реакций. Они используются, например, для синтеза аммиака, водорода, перекиси водорода, а также в синтезе органических соединений.
Платиновые катализаторы также находят широкое применение в автомобильной промышленности. Они используются в системе выхлопных газов для преобразования вредных выбросов в более безопасные соединения. Это позволяет снизить уровень загрязнения окружающей среды и сделать автомобили более экологически чистыми.
Платиновые катализаторы имеют сложную структуру, включая множество микроскопических активных центров. Они обладают высокой активностью, избирательностью и стабильностью, что позволяет им эффективно проводить каталитические реакции при относительно низких температурах и давлениях.
Никелевые катализаторы:

Никелевые катализаторы являются одним из наиболее распространенных видов катализаторов, используемых в различных химических процессах. Они широко применяются в различных отраслях промышленности, включая производство пластмасс, нефтехимию, фармацевтику и другие.
Одной из основных причин популярности никелевых катализаторов является их высокая активность и стабильность. Никель имеет способность катализировать различные реакции, включая гидрирование, окисление, полимеризацию и другие. Благодаря своим уникальным свойствам, никелевые катализаторы позволяют значительно увеличить скорость химических реакций и повысить выход целевого продукта.
Одним из наиболее известных примеров использования никелевых катализаторов является их применение в процессе гидрирования. Никель является активным катализатором для реакции превращения двойной связи в одинарную, что приводит к образованию насыщенных углеводородов. Эта реакция широко применяется в нефтяной промышленности для очистки и обогащения нефтепродуктов.
Никелевые катализаторы также находят применение в производстве пластмасс. Никель катализирует полимеризацию мономеров, таких как этилен, пропиле н и других, что позволяет получать полимерные материалы с различными свойствами. Никельевые катализаторы могут использоваться как гетерогенные, то есть присутствующие в реакционной смеси в виде частиц, так и гомогенные, то есть растворенные в реакционной среде.
Таким образом, никелевые катализаторы являются важным инструментом в различных химических процессах. Их высокая активность и стабильность позволяют увеличить скорость химических реакций и повысить выход целевых продуктов, что делает их широко применимыми в промышленности.
Кобальтовые катализаторы:

Кобальтовые катализаторы являются одним из наиболее распространенных типов катализаторов. Кобальт имеет высокую активность и устойчивость при высоких температурах, что делает его идеальным материалом для катализаторов.
Одним из основных применений кобальтовых катализаторов является использование их в химической промышленности для синтеза органических соединений. Кобальтовые катализаторы обладают способностью активировать связи между атомами в органических молекулах, что позволяет ускорить реакцию и повысить выход целевого продукта.
Кобальтовые катализаторы также широко применяются в процессах гидрогенирования, которые играют важную роль в нефтехимической и пищевой промышленности. Они способны эффективно превращать двойные и тройные связи органических соединений в одинарные связи при наличии водорода в реакционной среде.
Кроме того, кобальтовые катализаторы используются в процессе окисления органических соединений, например, в производстве фармацевтических препаратов и красителей. Они могут активировать молекулярный кислород и участвовать в образовании различных продуктов окисления.
Железные катализаторы:

Железо - один из основных видов металлов, применяемых в качестве катализаторов. Оно обладает высокой активностью и широким спектром применения.
Железные катализаторы могут использоваться в различных химических процессах, таких как окисление, гидрогенирование, полимеризация и многое другое. Они обладают высокой эффективностью и могут быть использованы в различных условиях.
Железо является одним из самых распространенных и доступных металлов, что делает его привлекательным для использования в катализаторах. Оно может быть получено из природных источников или произведено промышленным способом.
Железные катализаторы могут быть представлены в разных формах, таких как порошок, пленка или катализаторы на основе подложек. Они обладают высокой поверхностной активностью, что способствует эффективному взаимодействию с реагентами и увеличению скорости химических реакций.
Железные катализаторы также могут быть модифицированы путем добавления различных примесей или элементов. Это позволяет настроить их свойства и повысить их эффективность в конкретных реакциях.
Медные катализаторы:

Медные катализаторы – это один из видов металлических катализаторов, которые широко используются в различных процессах химической промышленности. Медь является одним из наиболее активных и эффективных катализаторов благодаря своим уникальным свойствам.
Медные катализаторы активно применяются в процессах окисления и гидрирования органических соединений, синтеза аммиака, очистки отходов и многих других химических реакциях. Они обладают высокой активностью и способностью оказывать мощное каталитическое действие при относительно низкой температуре.
Медь хорошо себя показывает в различных типах реакций, особенно в окислительных и восстановительных реакциях. Она способна обеспечить высокую скорость реакции и хорошую стабильность катализатора. Благодаря своей электропроводности медные катализаторы могут быть использованы в электрокатализе, что открывает новые возможности для промышленности и науки.
Вопрос-ответ

Какие основные виды металлов используются в качестве катализаторов?
В качестве катализаторов часто используют металлы платиновой группы, такие как платина, палладий, родий и их соединения. Также медь, железо и никель являются популярными катализаторами.
Какое значение имеют катализаторы в химии?
Катализаторы играют важную роль в химических реакциях. Они ускоряют скорость реакции, не расходуясь при этом, и могут превратить неактивные вещества в активные. Благодаря катализаторам можно достичь высокой эффективности и селективности при проведении химических превращений.
