Карбоновые кислоты – это органические соединения, содержащие в своей структуре карбонильную группу и кислородную функциональную группу, связанные с одним и тем же атомом углерода. Карбоновые кислоты обладают рядом уникальных химических свойств, которые определяют их взаимодействие с другими веществами, в том числе и с металлами.
Одним из наиболее известных и широко распространенных карбоновых кислот является уксусная кислота (CH3COOH), которая обладает рядом физических и химических свойств. В чистом виде она представляет собой прозрачную, летучую жидкость, обладающую резким запахом. Уксусная кислота легко растворяется в воде и многих органических растворителях.
Основные химические свойства карбоновых кислот обусловлены наличием карбоксильной функциональной группы (–COOH). Эта группа состоит из карбонильной группы (–CO–) и одной или нескольких гидроксильных групп (–OH), связанных с тем же самым атомом углерода. Карбоксильная группа обладает кислотными свойствами и может образовывать соли с основаниями, амиды, эстреры и другие соединения.
Взаимодействие карбоновых кислот с металлами происходит в реакции образования солей. Карбоксильная группа может отдавать протон, образуя карбоксилат-ион, который связывается с положительно заряженными ионами металлов. При этом образуется соль карбоновой кислоты.
Основные свойства карбоновых кислот

Карбоновые кислоты – это класс соединений, содержащих карбонильную группу (связь C=O) и карбоксильную группу (связь –C(=O)OH).
Одним из основных свойств карбоновых кислот является их кислотность. Карбоновые кислоты являются слабыми кислотами и образуют карбоксилатные ионы в растворах. Их кислотность обусловлена наличием карбоксильной группы, которая может отдавать протон в реакции с щелочью.
Важным свойством карбоновых кислот является их реакционная способность с металлами. Карбоновые кислоты могут образовывать соли с металлами, при этом металл занимает место в карбоксильной группе, образуя металлический карбоксилат. Например, уксусная кислота образует уксусанаты металлов, такие как натрий, калий, кальций и др.
Карбоновые кислоты также могут подвергаться реакциям эстерификации, образуя эфирные соединения. Эстеры карбоновых кислот широко используются в промышленности для получения различных продуктов, таких как пластмассы, растворители, ароматизаторы и др.
Карбоновые кислоты как кислоты Бренстеда-Лаури

Карбоновые кислоты являются классом органических соединений, которые обладают кислотными свойствами. Они могут служить прекрасными примерами кислот Бренстеда-Лаури - соединений, способных отдавать протоны (H+).
Взаимодействие карбоновых кислот с металлами является одной из наиболее известных и исследуемых реакций в органической химии. Когда карбоновая кислота вступает в контакт с металлом, происходит нейтрализация кислотного центра, т.е. протон переходит на металл.
Таким образом, карбоновые кислоты действуют как доноры протона при реакции с металлами. Эта реакция позволяет образовать соответствующие соли карбоновых кислот и металлов. Примером такой реакции может служить образование уксусных солей, например, ацетата натрия или кальция.
Имеет значение, какой металл вступает в реакцию с карбоновой кислотой. Некоторые металлы, такие как литий и натрий, реагируют с карбоновыми кислотами с большей интенсивностью, чем другие металлы, например, медь или железо. Это связано с электрохимическим потенциалом металла и его способностью принять протон.
Различные типы карбоновых кислот

Карбоновые кислоты являются классом органических соединений, содержащих функциональную группу карбоксильную группу (COOH). Они могут быть классифицированы на различные типы в зависимости от структуры и свойств.
Одним из основных типов карбоновых кислот являются насыщенные или алканиловые карбоновые кислоты. Они имеют одну или несколько метиловых групп (–CH3) присоединенных к карбоксильной группе. Примерами насыщенных карбоновых кислот являются уксусная кислота (CH3COOH), пропионовая кислота (CH3CH2COOH) и бутановая кислота (CH3CH2CH2COOH).
Другим распространенным типом карбоновых кислот являются ненасыщенные карбоновые кислоты. Они содержат двойные или тройные связи между атомами углерода в молекуле. Простые примеры ненасыщенных карбоновых кислот включают масляную кислоту (C17H33COOH) и акриловую кислоту (CH2=CHCOOH).
Ряд карбоновых кислот можно классифицировать как ароматические. Они содержат кольцевую структуру ароматического соединения, такого как бензольное кольцо. Примерами ароматических карбоновых кислот являются бензойная кислота (C6H5COOH) и терефталевая кислота (C6H4(COOH)2).
Термическое разложение карбоновых кислот

Карбоновые кислоты, являясь органическими соединениями, подвержены различным химическим реакциям. Одной из таких реакций является термическое разложение карбоновых кислот, которое может происходить при нагревании в органических синтезах или в промышленных процессах.
Термическое разложение карбоновых кислот происходит при высоких температурах и сопровождается образованием газовых продуктов, воды и углерода. При этом молекула карбоновой кислоты расщепляется на более простые соединения. Например, при разложении уксусной кислоты образуется углеродный оксид и вода.
Температура, при которой происходит разложение карбоновых кислот, зависит от их структуры и связывания. Некоторые карбоновые кислоты разлагаются при нагреве до 100 °C, в то время как для других требуется более высокая температура.
Разложение карбоновых кислот может протекать различными способами, в зависимости от условий и наличия катализаторов. Например, некоторые карбоновые кислоты могут разлагаться с образованием карбонильных соединений. Термическое разложение карбоновых кислот имеет применение в органическом синтезе и может быть использовано для получения определенных продуктов или веществ.
Взаимодействие карбоновых кислот с металлами
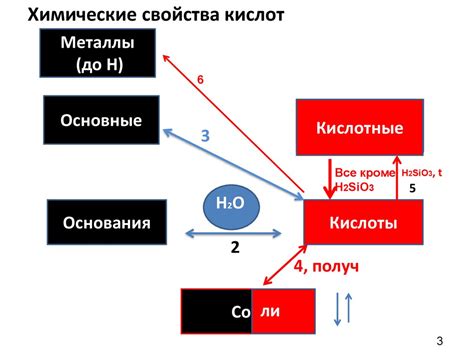
Карбоновые кислоты, представляющие собой органические соединения с карбонильной группой (-C=O) и карбоксильной группой (-COOH), часто проявляют активность в отношении многих металлов. Это связано с наличием кислотного центра в их молекулярной структуре, который способен взаимодействовать с ионами металлов.
Основным механизмом взаимодействия карбоновых кислот с металлами является ионный обмен. Карбоновые кислоты могут образовывать комплексы с металлами, где кислотный центр карбоксильной группы образует связь с ионом металла. Такие комплексы обычно обладают высокой стабильностью и могут иметь различные физические и химические свойства.
Взаимодействие карбоновых кислот с металлами может приводить к образованию осадков или растворов, в зависимости от растворимости полученных комплексов. Некоторые металлы, такие как натрий или калий, могут образовывать легко растворимые соли с карбоновыми кислотами, в то время как другие металлы, например свинец или медь, могут образовывать трудно растворимые осадки.
Взаимодействие карбоновых кислот с металлами может быть использовано в различных областях, таких как химический анализ, производство лекарственных препаратов и создание новых материалов. Изучение таких взаимодействий способствует расширению наших знаний о свойствах и поведении органических соединений и металлов в химических реакциях.
Получение металлосолей карбоновых кислот

Металлосоли карбоновых кислот получают путем взаимодействия карбоновых кислот с металлическими основаниями или металлическими солями. Процесс получения металлосолей карбоновых кислот является одним из важных методов синтеза данных соединений.
Взаимодействие карбоновой кислоты с металлическими основаниями происходит с образованием соли и выделением воды. Например, реакция уксусной кислоты с гидроксидом натрия приводит к образованию натриевой соли уксусной кислоты:
CH3COOH + NaOH → CH3COONa + H2O
Взаимодействие карбоновой кислоты с металлическими солями также позволяет получить металлосоли карбоновых кислот. Например, реакция между уксусной кислотой и серной кислотой приводит к образованию свинцовой соли уксусной кислоты:
2CH3COOH + Pb(NO3)2 → Pb(CH3COO)2 + 2HNO3
Таким образом, получение металлосолей карбоновых кислот позволяет расширить область применения данных соединений и использовать их, например, в качестве катализаторов, добавок в пластмассы, пищевых продуктах и многих других сферах.
Применение металлосолей карбоновых кислот

Металлосоли карбоновых кислот широко применяются в различных отраслях промышленности. Они обладают уникальными свойствами, которые позволяют использовать их в разных типах химических реакций и процессах.
Одним из наиболее распространенных применений металлосолей карбоновых кислот является использование их в качестве катализаторов в органическом синтезе. Металлосоли, содержащие карбоновые кислоты, могут повысить скорость химической реакции и улучшить ее эффективность. Это особенно актуально для реакций, требующих высокой температуры и давления.
Кроме того, металлосоли карбоновых кислот используются в процессах гальванического покрытия. Они способны образовывать стойкие пленки на поверхности металлических изделий, что позволяет защитить их от коррозии и повысить их долговечность. Применение металлосолей карбоновых кислот в гальванической обработке позволяет получать изделия с высоким качеством покрытия.
Также металлосоли карбоновых кислот находят применение в производстве красителей и пигментов. Они способны придать яркий и стойкий цвет различным материалам, таким как текстиль, пластик и краска. Это делает их незаменимыми компонентами в производстве красочной продукции.
Свойства металлосолей карбоновых кислот и их применение

Металлосоли карбоновых кислот обладают рядом особых свойств, которые определяют их применение в различных областях. Во-первых, эти соединения обладают хорошей растворимостью в воде, что позволяет использовать их в процессах химического анализа и синтеза.
Кроме того, металлосоли карбоновых кислот обладают высокой термической стабильностью, что делает их применимыми в процессе нагрева. Эти соединения выдерживают высокие температуры и не разлагаются при нагревании, что позволяет использовать их в производстве металлических изделий.
Также металлосоли карбоновых кислот обладают сильными восстановительными свойствами. Они могут взаимодействовать с окислителями и переходить в другие окислительно-восстановительные состояния. Это свойство позволяет применять металлосоли карбоновых кислот в электрохимических процессах и производстве батарей.
Таким образом, свойства металлосолей карбоновых кислот делают их полезными в различных областях, включая химический анализ, синтез, производство металлических изделий и электрохимические процессы. Изучение взаимодействия металлосолей карбоновых кислот с другими веществами позволяет расширить область их применения и создать новые материалы и технологии.
Вопрос-ответ

Что такое карбоновые кислоты?
Карбоновые кислоты - это органические соединения, содержащие группу -COOH, которая является карбоксильной группой. Они являются наиболее распространенными классами кислот и широко используются в различных промышленных и лабораторных процессах.
Каковы основные химические свойства карбоновых кислот?
Основные химические свойства карбоновых кислот включают их кислотность, окислительность и способность образовывать эфиры, амиды, соли и другие производные соединения. Они также могут проявлять полимеризацию и конденсацию в определенных условиях.
Какие металлы могут взаимодействовать с карбоновыми кислотами?
С карбоновыми кислотами могут взаимодействовать различные металлы, включая щелочные и щелочноземельные металлы, а также переходные металлы, такие как железо, медь и цинк. Эти взаимодействия могут происходить в форме образования солей или комплексных соединений.
Какова роль карбоновых кислот в промышленных процессах?
Карбоновые кислоты имеют широкое применение в промышленности. Они используются в производстве пластиков, лекарств, красителей, пищевых добавок и других химических соединений. Они также используются в процессах синтеза и катализа в лабораторных условиях.
Какие могут быть возможные реакции между металлами и карбоновыми кислотами?
Возможные реакции между металлами и карбоновыми кислотами включают образование солей, комплексных соединений и гидролиз. Некоторые металлы могут образовывать соли с карбоновыми кислотами, а другие могут образовывать комплексные соединения, при этом карбоксильная группа оседает на поверхности металла. Гидролиз карбоксильной группы также может происходить в присутствии металла.
