Активные металлы представляют собой элементы периодической системы, обладающие высокой химической активностью. Они легко образуют ионы, благодаря своей способности отдавать электроны. Структура электронной оболочки активных металлов является основой для понимания их химических свойств и реакций.
Электронная оболочка иона активного металла представляет собой распределение электронов по энергетическим уровням. Она состоит из нескольких энергетических уровней, на которых находятся электроны. Каждый уровень может содержать определенное количество электронов, определяемое формулой 2n^2, где n - номер уровня.
Ионы активных металлов имеют особую структуру электронной оболочки, отличную от нейтральных атомов. Обычно ионы активных металлов образуются при потере одного или нескольких электронов из внешнего энергетического уровня. В результате этого, электронная оболочка иона становится менее симметричной и нарушается строгий порядок распределения электронов по уровням.
Иными словами, структура электронной оболочки ионов активных металлов характеризуется присутствием большого числа несвязанных электронов, называемых «внешними» электронами. Эти электроны легко участвуют в химических реакциях, образуя связи с другими атомами и ионами, что определяет активность металла.
Роль электронной оболочки в химических свойствах ионов
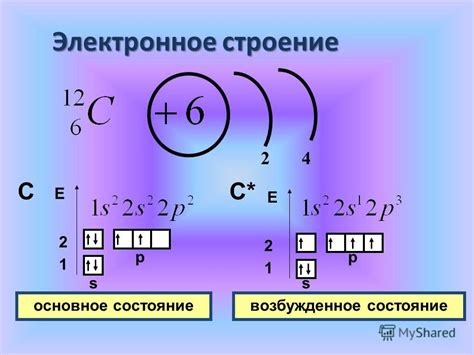
Электронная оболочка является ключевым фактором, определяющим химические свойства ионов активных металлов. Внешний электронный уровень оболочки, также известный как валентная оболочка, играет особенно важную роль в образовании химических связей и взаимодействии с другими элементами.
Наиболее активные металлы, такие как натрий и калий, имеют всего один электрон на своем внешнем уровне. Этот электрон легко отделяется от атома, образуя положительно заряженный ион. Такие ионы имеют тенденцию образовывать сильные ионные связи с атомами, обладающими высокой электроотрицательностью, такими как кислород или хлор. Это объясняет высокую реактивность ионов активных металлов и их способность быстро реагировать с другими веществами.
Электронная оболочка также влияет на размер ионов. Поскольку ионы активных металлов теряют один или несколько электронов, они становятся меньше по размеру, чем соответствующие атомы. Это связано с изменением притяжения ядра к оставшимся электронам, что приводит к сжатию оболочки. Сужение оболочки и ионная природа катионов активных металлов, в свою очередь, влияет на их растворимость, реактивность и способность образовывать соединения.
В отличие от ионов активных металлов, ионы переходных металлов имеют сложную электронную оболочку с несколькими энергетическими уровнями. В качестве валентных электронов могут выступать электроны с разных уровней оболочки, что придает ионам переходных металлов разнообразие химических свойств. Это позволяет им образовывать комплексные соединения, взаимодействовать с различными лигандами и проявлять разные окислительно-восстановительные свойства.
Таким образом, электронная оболочка играет важную роль в определении химических свойств ионов активных металлов. Ее состав и структура определяют способность ионов вступать в реакции, образовывать соединения и проявлять различные свойства. Познание этих особенностей помогает понимать химические процессы, связанные с ионами активных металлов, и применять их в различных областях науки и техники.
Структура ионов активных металлов и их электронная оболочка

Структура ионов активных металлов – это особенности расположения электронов в электронной оболочке иона, обусловленные его зарядом. У активных металлов, таких как натрий, калий или кальций, ионы формируются путем потери одного или нескольких электронов из своей внешней электронной оболочки.
Электронная оболочка активных металлов характеризуется наличием различных энергетических уровней, на которых находятся электроны. Внешняя электронная оболочка, называемая валентной оболочкой, играет важную роль в химических реакциях и определяет химические свойства элемента.
У активных металлов валентная оболочка содержит один или два электрона, что делает эти ионы потенциально нестабильными и склонными к реакциям с другими веществами. Например, ион натрия имеет конфигурацию 2,8,1, где последний электрон находится на валентной оболочке. Благодаря этой особенности, натрий активно взаимодействует с водой, сжигается на воздухе и образует соединения с другими элементами.
Ионы активных металлов могут образовывать различные соединения с разными зарядами. Если активный металл теряет один электрон, его ион будет иметь положительный заряд. Например, ион натрия Na+ имеет положительный заряд +1. Если металл теряет два электрона, его ион будет иметь положительный заряд +2. Например, ион кальция Ca2+ имеет положительный заряд +2.
Ионы активных металлов играют важную роль в различных процессах, таких как химические реакции, электролиз, образование солей и множество других. Их свойства и взаимодействие с другими веществами определяют особенности их использования в промышленности и науке.
Влияние структуры электронной оболочки на химическую активность ионов

Структура электронной оболочки является важным фактором, определяющим химическую активность ионов активных металлов. Она определяет возможность ионов взаимодействовать с другими веществами и принимать участие в реакциях.
Наиболее значимыми составляющими структуры электронной оболочки являются энергетические уровни иолоподобных отделов. Высокая энергия i-этапов позволяет активным металлам легко отдавать электроны, что делает их ярко выраженными электродонорами. Такая способность к отдаванию электронов делает ионы активных металлов активными в реакциях окисления.
Кроме того, на структуру электронной оболочки активных металлов также влияет размер ионов. Большой радиус ионов активных металлов позволяет им образовывать стабильные и слабосвязанные соединения с другими элементами.
Ионная радиальная сила и пространственный окрас заряда также оказывают влияние на химическую активность ионов активных металлов. Чем выше энергия заполненных оболочек, тем большая энергия отдачи будет у ионов активных металлов.
Таким образом, структура электронной оболочки, в том числе энергетические уровни, размер ионов, ионная сила и окрас заряда, играют важную роль в определении химической активности ионов активных металлов. Знание этих особенностей позволяет объяснить и предсказывать химические реакции, в которых участвуют ионы активных металлов.
Вопрос-ответ

Какую роль играют электроны в структуре электронной оболочки ионов активных металлов?
Электроны играют очень важную роль в структуре электронной оболочки ионов активных металлов. Они определяют химические и физические свойства ионов и межатомные связи в веществе.
Какие электровещества относятся к ионам активных металлов?
К ионам активных металлов относятся положительно заряженные ионы, которые образуются отдельными атомами металлов при потере одного или нескольких электронов из внешних электронных оболочек.
