Щелочные металлы являются группой элементов, которые находятся в первой группе периодической таблицы. Все они характеризуются общими свойствами, такими как низкая плотность, низкая температура плавления, высокая химическая активность и мягкость. Они также обладают свойством образования катионов с положительным зарядом.
Однако, среди щелочных металлов есть одно свойство, которое не является общим. Это свойство связано с их реакцией с водой. По сути, все щелочные металлы реагируют с водой, выделяя водород и образуя щелочные гидроксиды.
Однако, исключением является литий, который не реагирует с водой так же активно, как остальные щелочные металлы. В результате реакции лития с водой образуется гидроксид лития и меньшее количество выделяется водорода по сравнению с остальными щелочными металлами.
Таким образом, свойство реакции с водой является отличительной особенностью лития среди щелочных металлов и отличает его от остальных элементов этой группы периодической таблицы.
Свойства щелочных металлов

1. Металлический блеск: Щелочные металлы обладают ярким металлическим блеском, что делает их заметными и отличимыми от других элементов.
2. Низкая плотность: Все щелочные металлы имеют низкую плотность, что означает, что они легкие и обладают незначительной массой. Это делает их удобными для использования в различных приложениях.
3. Активность: Щелочные металлы являются очень активными химическими элементами и легко вступают в реакцию с другими веществами. Они образуют стабильные и летучие соединения с кислотами, кислотными оксидами и водой.
4. Низкая температура плавления и кипения: Некоторые щелочные металлы, такие как литий, имеют низкую температуру плавления и кипения. Это делает их полезными в различных процессах и технологиях, таких как производство аккумуляторов и сплавов.
5. Сильные щелочные свойства: Щелочные металлы обладают сильными щелочными свойствами. Они могут эффективно нейтрализировать кислотные растворы и использоваться для регулирования pH-уровня.
6. Хорошая электропроводность: Щелочные металлы являются очень хорошими проводниками электричества. Они обладают высокой электропроводностью, что делает их полезными для производства проводов и электротехнических устройств.
7. Низкая твердость: Щелочные металлы имеют низкую твердость, поэтому они могут быть легко резаны ножом или другими острыми предметами.
8. Плохая устойчивость к воздействию влаги и кислорода: Щелочные металлы реагируют с водой и кислородом, что делает их неустойчивыми в атмосфере. Они должны быть хранены под водой или в инертной среде, чтобы избегать их окисления и реакций с влагой.
9. Образование оксидов: Щелочные металлы образуют оксиды при реакции с кислородом. Оксиды щелочных металлов широко используются в производстве стекла, эмалей и керамики.
10. Одноэлектронность: Щелочные металлы имеют одну электронную оболочку, что делает их химическое поведение уникальным и позволяет им легко образовывать ионы с положительным зарядом.
Общие свойства щелочных металлов

Щелочные металлы - это группа элементов, которые находятся в первой группе периодической системы и включают литий, натрий, калий, рубидий, цезий и франций. У них есть несколько общих свойств, которые делают их уникальными в химии.
Подобно другим металлам, щелочные металлы обладают металлическим блеском и хорошей теплопроводностью. Они также являются отличными проводниками электричества. Это связано с их способностью образовывать ионы с положительным зарядом, которые легко передают электроны.
Щелочные металлы очень активны соотносительно взаимодействий с кислородом и водой. Они реагируют с кислородом, образуя оксиды, и с водой, образуя гидроксиды. Это отличает их от большинства других металлов, которые не так быстро реагируют с водой и кислородом. Реактивность щелочных металлов связана с низкой энергией ионизации, что делает их электрохимически активными.
- Щелочные металлы имеют низкую плотность и низкую температуру плавления. Например, литий является легким металлом, который имеет плотность всего 0,53 г/см³.
- Они имеют низкую жесткость и податливость, что делает их легко обрабатываемыми. Они также очень пластичные и способны подвергаться деформации без разрушения.
- Щелочные металлы образуют стабильные ионы с положительным зарядом, которые легко реагируют с другими веществами. Они обладают высокой электроотрицательностью и способностью образовывать соли.
- Щелочные металлы имеют низкую теплостойкость, что ограничивает их использование в высокотемпературных процессах.
Важно отметить, что одним из необщих свойств щелочных металлов является их плотная кристаллическая упаковка. Только литий и натрий имеют кубическую упаковку атомов, в то время как остальные щелочные металлы имеют кубические упаковки как в основной фазе, так и в подвижных состояниях.
Исключение среди свойств щелочных металлов
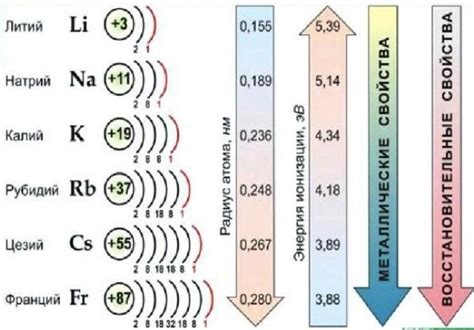
Щелочные металлы – это группа элементов периодической системы, включающая литий, натрий, калий, рубидий, цезий и франций. Все они обладают рядом общих свойств, таких как низкая плотность, низкая температура плавления, высокая химическая реактивность и способность образовывать ионы с положительным зарядом. Однако, среди этих свойств есть и исключение, которое отличает один щелочный металл от других.
Исключением среди свойств щелочных металлов является их плотность. Все щелочные металлы имеют достаточно низкую плотность по сравнению с другими элементами периодической системы, однако самым легким и наименее плотным является литий. Плотность лития составляет всего 0,53 г/см³, что гораздо ниже, например, плотности свинца и железа. В то же время, у остальных щелочных металлов, начиная с натрия и до франция, плотность уже значительно выше и составляет от 0,97 до 1,87 г/см³.
Такое исключение можно объяснить различной структурой и атомной упаковкой этих элементов. Литий имеет кубическую гранецентрированную решетку, в то время как остальные щелочные металлы обладают гранецентрированной решеткой гранного центрирования. Это приводит к наличию у лития большей прослойки в его кристаллической структуре, что делает его менее плотным по сравнению с другими щелочными металлами.
Таким образом, плотность лития является исключением среди свойств щелочных металлов. Оно отличается от плотности остальных элементов этой группы и объясняется особенностями их структуры и атомной упаковки.
Вопрос-ответ

Является ли тугоплавкостью одним из свойств щелочных металлов?
Да, во всех щелочных металлах (литии, натрии, калии, рубидии и цезии) тугоплавкость является общим свойством.
Могут ли щелочные металлы образовывать соединения с кислородом?
Да, щелочные металлы могут образовывать соединения с кислородом, например, оксиды щелочных металлов.
Бывают ли щелочные металлы твёрдыми веществами при комнатной температуре?
Нет, все щелочные металлы имеют низкие плавления и при комнатной температуре являются жидкими или мягкими металлами.
Могут ли щелочные металлы образовывать ионы с положительным зарядом?
Да, все щелочные металлы образуют ионы с положительным зарядом, которые легко отдают электрон и образуют ионный связи.
Присутствуют ли щелочные металлы в природе в свободном состоянии?
Нет, щелочные металлы не встречаются в природе в свободном состоянии из-за их высокой реактивности, они всегда существуют в виде ионов или соединений.
