Металлы щелочные – это группа химических элементов I группы периодической системы, включающая литий, натрий, калий, рубидий, цезий и франций. Они отличаются высокой реакционной способностью, сильно реагируя с водой, кислородом и другими веществами. Помимо этого, данные металлы обладают уникальными свойствами, особенно в отношении своего пламени.
Внушительное пламя металлов щелочных привлекает внимание своей яркостью и особенной окраской. Например, пламя лития имеет красный оттенок, натрия - желтый, калия - фиолетовый, рубидия - фиолетовый с красным оттенком, цезия - голубой. Это связано с тем, что при горении металл подает электроны в воздух, которые активируют атомы кислорода, а затем возникает яркий свет. Таким образом, цвет пламени металлов щелочных зависит от конкретного элемента и их электронной структуры.
Кроме внешней красоты, пламя металлов щелочных обладает и другими особенностями. Например, они горят с огромной яркостью и интенсивностью, что и делает их таким привлекательными для шоу и представлений. Важно отметить, что пламя металлов щелочных является очень опасным и может приводить к серьезным ожогам. Поэтому, при работе с этими металлами необходимо соблюдать все меры безопасности и использовать специальное оборудование.
Понятие и область применения щелочных металлов

Щелочные металлы - это группа элементов, которые относятся к первой группе периодической таблицы химических элементов. Включает в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они являются металлами с низкой плотностью и хорошей электропроводностью.
Щелочные металлы широко используются в различных областях благодаря своим уникальным свойствам. Например, литий активно применяется в производстве литий-ионных аккумуляторов, которые используются в мобильных телефонах, ноутбуках и электрических автомобилях.
Натрий нашел свое применение в пищевой и химической промышленности. Он используется в качестве пищевой добавки (E-номер 500) и для производства луга, сырца для получения щелочей и многих других химических соединений.
Калий широко используется в сельском хозяйстве в виде удобрений. Он является важным элементом для роста растений и участвует в регуляции осмотического давления. Калийные удобрения повышают урожайность и качество сельскохозяйственных культур.
Рубидий и цезий находят свое применение в научных исследованиях и электронике. Они используются в производстве фоточувствительных элементов, лазерных систем, а также в атомно-ядерной промышленности.
Франций, самый редкий и радиоактивный из щелочных металлов, имеет очень ограниченное применение и встречается только в незначительных количествах в природе.
Химические свойства и внушительное пламя щелочных металлов
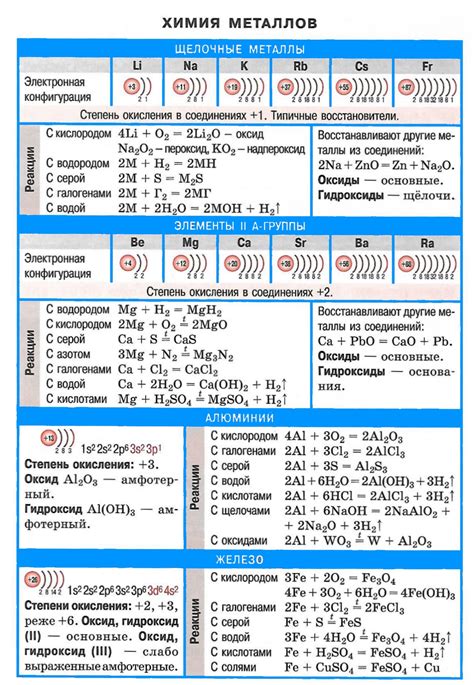
Щелочные металлы – это элементы первой группы периодической системы, включающие литий, натрий, калий, рубидий, цезий и франций. Они имеют сильно выраженные химические свойства, обусловленные наличием только одного электрона на внешнем энергетическом уровне своей электронной оболочки. Этот электрон легко отдается, что делает щелочные металлы крайне реактивными.
Из-за высокой реактивности, щелочные металлы очень быстро окисляются на воздухе. Реакция с кислородом протекает с выделением тепла и является сильно воспламеняющейся, что проявляется во внушительном пламени. Исключением является литий, который реагирует с кислородом медленнее, но все равно может подпаливать.
При сжигании щелочных металлов образуется пламя ярко-желтого цвета с насыщенным оранжевым оттенком. Это явление объясняется наличием возбужденных атомов, которые излучают свет при возвращении на нижние энергетические уровни. Излучение происходит в видимой области спектра и придает пламени характерный яркий цвет. Особенно внушительно пламя щелочных металлов выглядит в темноте, что делает их незаменимым инструментом для эффектных пиротехнических салютов.
Особенности пламени щелочных металлов связаны не только с их химическими свойствами, но и с физическими процессами, происходящими во время горения. Различные металлические ионы способны осуществлять испарение и затем восстановиться в непосредственной близости от фламинга, формируя новое пламенное явление. В результате это создает пеструю игру красок во время сгорания щелочных металлов, делая их пламя по-настоящему впечатляющим и захватывающим для наблюдателей.
Основные представители щелочных металлов
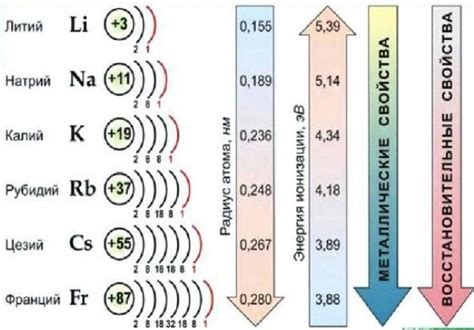
Щелочные металлы - это элементы с самыми низкими энергиями и наиболее активные металлы в периодической системе. Они относятся к первой группе элементов и включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Литий (Li) – самый легкий из щелочных металлов и третий по реактивности после калия и натрия. Он используется в производстве аккумуляторов и в ядерной энергетике, а также имеет медицинские применения.
Натрий (Na) – находится всегда в соединениях с другими элементами, особенно хлором, и широко используется в промышленности для производства щелочи, бумаги и мыла. Также натрий существенно влияет на обмен веществ в организмах живых существ.
Калий (K) – важный макроэлемент, который необходим для правильной работы организма человека. Он участвует в регуляции водно-солевого обмена, нервной системы и сердечной деятельности. Калий также используется в промышленности для производства удобрений, стекла и щелочи.
Рубидий (Rb) – имеет схожие свойства с калием и используется в научных исследованиях, в производстве специальных стекол и в электронике.
Цезий (Cs) – самый реактивный из щелочных металлов. Он применяется в научных исследованиях, в ядерной энергетике и в медицине для лечения рака.
Франций (Fr) – самый редкий и наиболее реактивный из щелочных металлов. Он очень трудно получить в чистом виде и мало изучен.
Щелочные металлы имеют много общих свойств, включая низкую плотность, низкую кипящую точку и химическую активность. Однако каждый представитель щелочных металлов имеет свои особенности, что делает их уникальными и полезными для различных областей науки, промышленности и медицины.
Физические свойства и химическая активность щелочных металлов

Физические свойства: Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают рядом уникальных физических свойств. Во-первых, они являются мягкими и легкоплавкими элементами. Например, калий тает уже при температуре 63 градусов Цельсия. Кроме того, щелочные металлы обладают низкой плотностью, что делает их легкими веществами. Например, литий является наименее плотным из всех металлов и легче остальных элементов таблицы, его плотность составляет всего 534 кг/м³.
Химическая активность: Щелочные металлы - самые активные металлы в периодической системе элементов. Их основные окислители образуются соединения с отрицательным зарядом, такие как гидроксиды и гидриды. Окисление щелочных металлов происходит воздухом и водой. Например, литий очень реактивен и горит с ярким пламенем при контакте с воздухом. Щелочные металлы также образуют соли, являющиеся основными компонентами многих минералов и горных пород.
Химические свойства: Щелочные металлы обладают сильной основностью и образуют щелочные растворы. Они реагируют с кислородом, хлором и другими неорганическими веществами. Щелочные металлы хорошо проводят тепло и электричество. Их соединения обладают светочувствительностью и используются в фотоэлементах и светочувствительных материалах. Кроме того, многие сплавы щелочных металлов обладают высокой термостойкостью и применяются в различных технологических процессах, включая производство стекла и керамики.
Использование в промышленности: Щелочные металлы имеют широкое применение в промышленности. Например, калий используется в производстве удобрений, стекла и мыла. Натрий широко применяется в пищевой и химической промышленности, а также в производстве противогололедных смесей для дорожных работ. Литий используется в производстве батарей, лекарств и сплавов. Рубидий и цезий, хотя и используются в значительно меньшей степени, также имеют применение в различных технологических процессах и научных исследованиях.
Применение щелочных металлов в промышленности и научных исследованиях
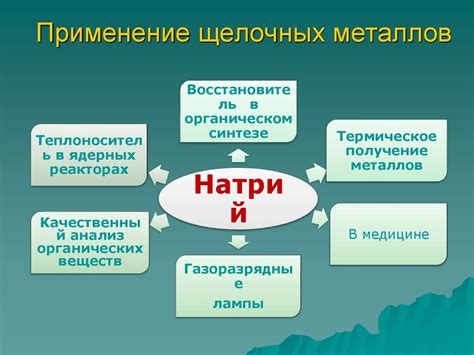
Щелочные металлы, такие как литий, натрий, калий и рубидий, широко используются в различных областях промышленности и научных исследований.
Одним из основных применений щелочных металлов является их использование в производстве щелочных батарей. Литий-ионные батареи, содержащие литий, обладают высокой энергоемкостью и широко применяются в мобильных устройствах, электромобилях и других портативных устройствах.
Щелочные металлы также находят применение в процессах производства стекла. Калий и натрий добавляются в стекловарение для изменения его химических и физических свойств. Благодаря этому можно получить различные типы стекла, такие как термостойкое, прозрачное и цветное.
В научных исследованиях щелочные металлы используются в качестве катализаторов и индикаторов реакций. Например, натрий может использоваться в качестве катализатора в протонные передачные реакции, а калий может служить в качестве индикатора в титровании.
Кроме того, щелочные металлы применяются в различных экспериментах и исследованиях в области физики и химии. Они используются для создания разрядов плазмы в исследованиях плазменной физики, а также для синтеза новых материалов и соединений.
В целом, применение щелочных металлов в промышленности и научных исследованиях широко и разнообразно. Они играют важную роль в создании новых технологий и развитии различных отраслей науки и промышленности.
Щелочные металлы в повседневной жизни и их важность для человека

Щелочные металлы – это группа химических элементов, которые широко используются в повседневной жизни человека. Они имеют особые свойства и играют важную роль в различных отраслях промышленности.
Первым и наиболее известным представителем щелочных металлов является натрий. Его соединения применяются в пищевой промышленности для приготовления различных продуктов, таких как сыры, мясные изделия, напитки и т.д. Натрий также используется в производстве стекла, мыла и многих других материалов.
Калий – другой важный элемент из группы щелочных металлов. Он необходим для нормального функционирования сердечно-сосудистой системы и нервной системы человека. Калий содержится во многих продуктах питания, включая фрукты, овощи, молоко и мясо. Его также можно найти в удобрениях, которые повышают плодородие почвы и увеличивают урожайность сельскохозяйственных культур.
Литий – еще один важный элемент из группы щелочных металлов. Его соединения используются в производстве аккумуляторов, освещения, стекла и керамики. Литий также применяется в медицине для лечения психических расстройств, таких как биполярное расстройство и депрессия.
В целом, щелочные металлы играют важную роль в повседневной жизни человека, обеспечивая его потребности в пище, энергии и материалах. Они также имеют множество применений в науке и промышленности, делая их неотъемлемой частью современного мира.
Вопрос-ответ

Какие металлы относятся к щелочным?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Чем так особенно пламя, создаваемое щелочными металлами?
Пламя, создаваемое щелочными металлами, имеет ярко-желтый цвет и является очень ярким и внушительным. Это связано с тем, что при сжигании щелочных металлов происходит выделение большого количества энергии в виде тепла и света.
