Щелочные металлы - это элементы, которые находятся в первой группе периодической таблицы: литий, натрий, калий, рубидий, цезий и франций. Они отличаются высокой химической активностью и образуют различные соединения с другими элементами.
Одной из основных характеристик щелочных металлов является их способность легко реагировать с кислородом из воздуха. При этом образуются оксиды щелочных металлов, такие как оксид лития (Li2O), оксид натрия (Na2O) и другие. Эти оксиды обладают свойствами щелочных соединений и могут растворяться в воде с образованием щелочных растворов.
Реакции щелочных металлов с водой также приводят к образованию щелочных растворов. Например, при реакции натрия с водой образуется гидроксид натрия (NaOH) и выделяется водород. Эта реакция обычно сопровождается выделением тепла и образованием пламени.
Щелочные металлы способны реагировать и с кислотами. При этом образуются соли, например, соль натрия (NaCl). Кроме того, щелочные металлы могут образовывать различные соединения с другими элементами, такие как кислород, сера, азот и другие.
Важно отметить, что все эти реакции можно описать с помощью химических уравнений. Например, реакция натрия с водой будет выглядеть следующим образом: 2Na + 2H2O → 2NaOH + H2.
Таким образом, свойства щелочных металлов определяют их активность и способность образовывать различные соединения при взаимодействии с другими элементами. Эти реакции можно описать с помощью химических уравнений, что позволяет предсказывать и изучать их химическую активность.
Физические свойства щелочных металлов

Щелочные металлы - это элементы первой группы периодической таблицы, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У этих металлов есть несколько общих физических свойств, которые определяют их характеристики и схожие реакции.
Первое отличительное свойство щелочных металлов - это низкая плотность. Они все являются легкими металлами, которые имеют плотность меньше, чем у большинства других металлов. К примеру, литий - самый легкий металл с плотностью всего около 0,5 г/см³, а калий - один из самых легких металлов с плотностью около 0,9 г/см³.
Второе важное свойство щелочных металлов - это низкая температура плавления и кипения. Литий, например, плавится при температуре всего 180 °C, а калий - при 63 °C. Это делает эти металлы мягкими и легко плавящимися при комнатной температуре.
Третье свойство щелочных металлов - это высокая электроотрицательность. Они относятся к группе самых химически активных элементов, вступая в реакции с многими другими веществами. Их реактивность связана с высокой склонностью отдавать электроны, что делает их хорошими веществами для получения ионов с положительным зарядом.
Четвертое важное свойство щелочных металлов - это мягкость и пластичность. Они могут быть легко режущимися и даже растягивающимися при небольшой деформации. Например, кусок калия можно легко резать ножом. Это свойство делает эти металлы полезными во многих областях, таких как производство батареек или сплавов для использования в различных приборах.
И наконец, пятое свойство щелочных металлов - это высокая проводимость тепла и электричества. Они являются отличными проводниками, что делает их полезными в различных электрических и тепловых приборах.
Щелочные металлы в химических реакциях

Щелочные металлы, такие как литий, натрий, калий, реагируют с водой, кислородом и другими веществами, образуя различные соединения. Они обладают высокой реакционной способностью, что обусловлено их низкими энергиями ионизации и положительными потенциалами окисления.
Реакция щелочных металлов с водой происходит с образованием гидроксидов и выделением водорода. Например, литий реагирует с водой, образуя гидроксид лития и выделяя водород:
Li + H2O → LiOH + H2
Эта реакция сопровождается значительным выделением тепла и возгоранием выделяющегося водорода.
Щелочные металлы также проявляют активность в реакциях с кислородом. Например, натрий реагирует с кислородом воздуха, образуя оксид натрия:
4Na + O2 → 2Na2O
Эта реакция является окислительно-восстановительной и сопровождается высвобождением энергии.
В реакциях щелочных металлов с другими веществами также образуются различные продукты. Например, калий реагирует с хлором, образуя хлорид калия:
2K + Cl2 → 2KCl
Реакция щелочных металлов с различными соединениями обусловлена их способностью образовывать ионы с положительным зарядом и вступать в ионные реакции.
Взаимодействие щелочных металлов с кислотами

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, проявляют активность при взаимодействии с кислотами.
Когда щелочный металл вступает в реакцию с кислотой, образуется соль и выделяется водород. Эта реакция называется нейтрализацией.
Уравнение реакции между щелочным металлом и кислотой обычно выглядит так:
Металл + Кислота → Соль + Водород
Например, реакция между натрием и соляной кислотой будет выглядеть следующим образом:
2Na + 2HCl → 2NaCl + H2
Особенностью реакции щелочных металлов с кислотами является быстрое выделение водорода, что сопровождается шипением и пением.
Иногда могут происходить и другие виды реакций между щелочными металлами и кислотами, в зависимости от конкретных условий, например, полностью окисляющей или кислородно-восстановительной природы кислоты.
Взаимодействие щелочных металлов с кислотами имеет широкое применение в химической промышленности и повседневной жизни. Например, натрий может использоваться для нейтрализации кислоты в случае попадания ее на кожу или одежду.
Реакции щелочных металлов с водой

Реакции щелочных металлов с водой являются одной из наиболее известных и демонстрируют их активность. Щелочные металлы такие, как литий (Li), натрий (Na), калий (K) и др., относятся к первой группе периодической системы. Одним из их общих свойств является их способность реагировать с водой.
В реакции с водой щелочные металлы образуют гидроксиды и выделяются водород. Процесс можно описать следующим уравнением:
- 2M + 2H2O → 2M(OH) + H2
Эта реакция является экзотермической и происходит с выделением тепла. При контакте с водой щелочные металлы активно реагируют, образуя пузырьки газа и выпуская его в воду.
Реакции щелочных металлов с водой являются быстрыми и сопровождаются характерными явлениями. Например, металлы лития и натрия реагируют с водой настолько резво, что могут начинать гореть. При этом образуется гидроксид щелочного металла, являющийся щелочным раствором в воде.
Кроме того, реакции щелочных металлов с водой играют важную роль в различных областях, таких как энергетика и производство водорода. Эти реакции можно использовать для получения водорода, который является одним из наиболее распространенных и важных химических элементов.
Образование гидроксидов при взаимодействии щелочных металлов с водой

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs), проявляют сильную реакцию при контакте с водой. При этом образуются гидроксиды этих металлов.
Во время реакции щелочные металлы активно реагируют с молекулами воды. Металлы передают электроны молекулам воды, образуя гидроксиды и выделяя водород. Уравнение реакции между щелочным металлом и водой можно записать следующим образом:
Металл + Вода → Гидроксид металла + Водород
Процесс образования гидроксидов щелочных металлов происходит достаточно быстро и сильно выделяет тепло. Именно по этой причине при реакции с водой можно наблюдать плавление металла, его горение или даже взрыв.
Образованные гидроксиды щелочных металлов обладают щелочными свойствами, т.е. они растворяются в воде, образуя ионно-молекулярные решения с высоким уровнем pH. Гидроксиды щелочных металлов широко используются в различных отраслях промышленности и научных исследованиях, включая производство щелочных батарей и препаратов для регулирования кислотно-щелочного баланса организма.
Щелочные металлы и соли
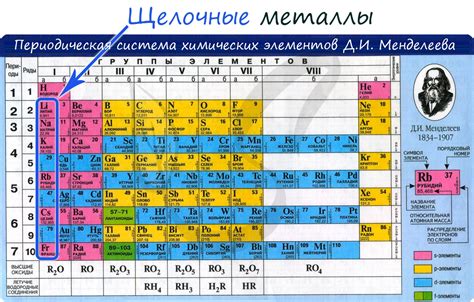
Щелочные металлы – это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются высокой реактивностью и обладают важными свойствами, которые делают их полезными в различных областях науки и технологий.
Щелочные металлы имеют низкую плотность и низкую температуру плавления, что делает их мягкими и легкообрабатываемыми веществами. Они имеют металлический блеск и образуют ионные соединения с различными антионами. Многие из них образуют стабильные соли, которые широко используются в химической промышленности и в медицине.
Реакции щелочных металлов с водой являются одной из наиболее известных их химических свойств. При взаимодействии с водой щелочные металлы образуют щелочное растворение и высвобождаются водород газ. Реакция происходит с выделением тепла и может быть очень сильной и взрывоопасной, особенно с калием и цезием. Эта химическая реакция широко используется в процессе получения водорода.
Соли щелочных металлов имеют широкое применение в различных отраслях науки и технологий. Они используются в производстве стекла, мыла, щелочных батарей, очистке воды, а также в качестве питательных веществ в сельском хозяйстве. Некоторые соли щелочных металлов используются в медицине для лечения различных заболеваний.
Реакция щелочных металлов с неметаллами
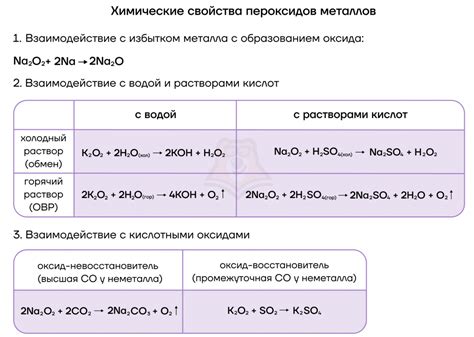
Щелочные металлы обладают высокой реакционной способностью и легко взаимодействуют с неметаллами. Одним из самых распространенных примеров такого взаимодействия является реакция щелочных металлов с кислородом.
В результате этой реакции образуется оксид щелочного металла. Например, натрий, взаимодействуя с кислородом, образует оксид натрия:
4Na + O2 → 2Na2O
Щелочные металлы также реагируют с другими неметаллами, например, с серой и фосфором. Результатом этих реакций являются соответствующие соединения:
2Na + S → Na2S
2Na + 2P → 2NaP
Взаимодействие щелочных металлов с галогенами, такими как хлор, бром и йод, также приводит к образованию соответствующих соединений. Например, натрий реагирует с хлором и образует хлорид натрия:
2Na + Cl2 → 2NaCl
Реакции щелочных металлов с неметаллами часто сопровождаются выделением энергии в виде тепла и света, а также характерными изменениями цвета и образованием газовых продуктов. Эти реакции могут быть полезными в различных промышленных процессах и они широко используются для получения нужных соединений.
Щелочные металлы в аналитической химии
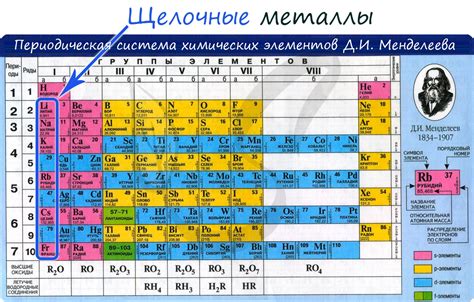
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, играют важную роль в аналитической химии. Они обладают рядом уникальных свойств и реакций, которые позволяют их использовать в различных аналитических методах и процедурах.
Одним из наиболее распространенных способов использования щелочных металлов в аналитической химии является использование их соединений в качестве калибровочных стандартов. Например, растворы щелочных металлов могут быть использованы для калибровки аналитических приборов, таких как фотометры или спектрофотометры, для определения концентрации веществ в образце.
Щелочные металлы также часто используются в качестве реагентов для определения различных ионов. Например, натрий может быть использован в качестве реагента для определения содержания кальция в воде. Кальций реагирует с натрием, образуя осадок, который можно визуально определить и количественно измерить.
Другим важным применением щелочных металлов в аналитической химии является их использование в методах экстракции. Экстракция — это процесс разделения компонентов смеси путем перераспределения вещества между двумя несмешивающимися фазами. Щелочные металлы могут быть использованы в качестве экстрагентов, которые позволяют разделить и изолировать определенные вещества из смеси.
В заключение, щелочные металлы играют важную роль в аналитической химии. Их свойства и реакции позволяют использовать их в различных аналитических методах и процедурах, от калибровки приборов до определения содержания различных ионов и методов экстракции. Изучение и использование щелочных металлов в аналитической химии является неотъемлемой частью работы аналитика и способствует получению точных и надежных результатов при анализе различных образцов.
Вопрос-ответ

Какие свойства имеют щелочные металлы?
Щелочные металлы обладают несколькими характерными свойствами. Они сильно реактивны и реагируют с водой, кислородом и другими элементами. Они также имеют низкую плотность, мягкость и низкую температуру плавления.
Что происходит, когда щелочные металлы вступают в реакцию с кислородом?
Реакция щелочных металлов с кислородом приводит к образованию щелочной оксидной соли. Например, реакция натрия с кислородом будет выглядеть следующим образом: 4Na + O₂ → 2Na₂O. Результатом такой реакции будет образование оксида натрия.
Какие уравнения описывают реакцию между щелочными металлами и кислотами?
Реакция между щелочными металлами и кислотами приводит к образованию солей и воды. Например, реакция натрия с соляной кислотой будет выглядеть следующим образом: 2Na + 2HCl → 2NaCl + H₂. Результатом такой реакции будет образование хлорида натрия и воды.
