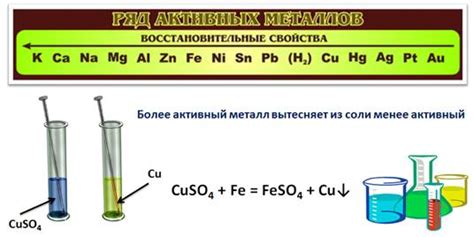
Атомы металлов представляют собой элементарные частицы, из которых состоят все металлические вещества. Они обладают уникальными свойствами, определяющими их способность к восстановлению. Эти особенности связаны с особенной структурой атома металла.
Строение атома металла состоит из ядра, которое содержит протоны и нейтроны, а также электронной оболочки, в которой находятся электроны. Ядро является положительно заряженным и чаще всего имеет малую массу по сравнению с общей массой атома. Электроны, наоборот, обладают отрицательным зарядом и являются главными участниками реакций восстановления.
Роль атомов металлов в восстановительных свойствах связана с их способностью отдавать электроны и становиться положительно заряженными ионами. Именно эта особенность определяет их активность во многих химических реакциях. Атомы металлов способны вступать во взаимодействие с веществами, в окружающей среде, и устранять у них избыточные электроны, восстанавливая их.
Поэтому металлы широко используются в реакциях восстановления, так как они способны передавать электроны другим веществам и изменять их степень окисления. Эта возможность металлов делает их незаменимыми в различных процессах, таких как электрохимические реакции, изготовление металлических сплавов, производство батарей и аккумуляторов и т.д.
Структура атомов металлов

Атом металла состоит из ядра и электронов, которые образуют облако вокруг ядра. Ядро состоит из протонов и нейтронов, а электроны находятся на разных энергетических уровнях.
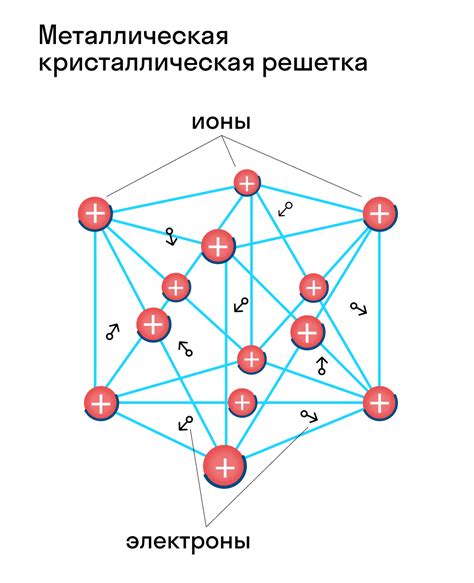
В основе структуры атомов металлов лежит особенность внутреннего строения. Металлы характеризуются наличием свободных электронов в своей внешней оболочке. Именно эти свободные электроны и отвечают за основные физические и химические свойства металлов.
Облако электронов является металлической связью, которая отвечает за способность металлов проводить тепло и электричество. Металлическая связь образуется в результате взаимодействия между свободными электронами и положительно заряженными ионами в ядре.
Структура атомов металлов обеспечивает металлические свойства, такие как высокая пластичность, тугоплавкость и хорошая термическая и электрическая проводимость. Благодаря свободным электронам металлы могут образовывать кристаллическую решетку, что делает их прочными и жесткими материалами.
Важно отметить, что структура атомов металлов может отличаться в зависимости от конкретного металла. Некоторые металлы могут иметь специфическую кристаллическую решетку или особенности в расположении свободных электронов в своей внешней оболочке.
Внешний вид и химический состав
Металлы являются одной из основных групп элементов, характеризующихся своими уникальными физическими и химическими свойствами. Внешний вид металлов отличается блеском и металлическим оттенком, что вызвано способностью атомов металлов отражать свет. Их поверхность обычно гладкая и блестящая.
Химический состав атомов металлов включает основную группу элементов таблицы Д.И. Менделеева, таких как железо, алюминий, медь, свинец и др. Основой строения атома металла является ядро, состоящее из протонов и нейтронов, и электронная оболочка, включающая электроны. Металлы обладают способностью образовывать ионные связи, что позволяет им вступать в химические реакции с другими веществами.
Металлы характеризуются высокой теплопроводностью и электропроводностью благодаря свободному движению электронов в их структуре. Эти свойства позволяют металлам применяться в различных областях, включая электротехнику, строительство, авиацию и многие другие. Большинство металлов также обладает высокой пластичностью и прочностью, что делает их идеальными для использования в процессе обработки и создания различных конструкций.
Металлы также имеют способность восстанавливать свою структуру после воздействия различных факторов, таких как деформация или окисление. Это свойство делает металлы незаменимыми материалами для производства прочных и устойчивых к внешним воздействиям изделий, таких как автомобили, мебель и многие другие.
Типы атомных связей
В металлах преобладают ионные и металлические связи, которые определяют их особенности в строении и свойствах.
Ионные связи формируются между атомами, взаимодействующими через передачу или прием электронов. В металлах связь обычно происходит между катионами металла и электронами в валентной оболочке, что приводит к образованию сети положительных ионов и свободных электронов. Ионные связи обеспечивают высокую прочность металлов и их способность к проводимости тока.
Металлические связи характеризуются перемещением электронов между атомами, поддерживающих металлическую решетку. В этом случае все атомы в металле делят общие электроны, создавая так называемое "море" электронов, которое обеспечивает высокую электропроводимость и теплопроводность металлов.
Особенностью атомного строения металлов является наличие свободных электронов, что делает их хорошими проводниками электричества и тепла. Это свойство играет важную роль во множестве приложений - от электрических проводов и деталей электроники до теплообменников и каталитических процессов.
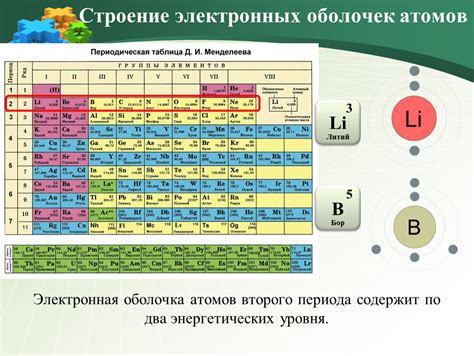
Расположение электронов и энергетические уровни
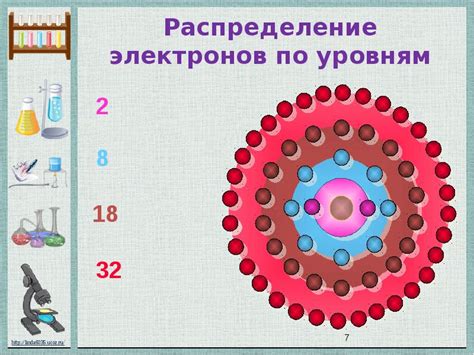
Атомы металлов состоят из ядра, которое содержит протоны и нейтроны, и окружающей ядра области, называемой электронной оболочкой. Электроны располагаются на энергетических уровнях, которые представляют собой области пространства, где электроны с наибольшей вероятностью могут быть найдены.
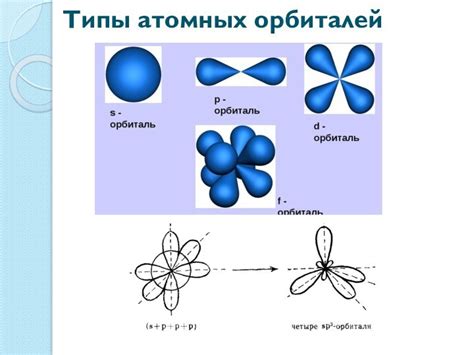
Наиболее близкие к ядру энергетические уровни называются s-уровнями, где максимальное количество электронов составляет 2. На следующем уровне - p-уровне - электроны могут располагаться в трех орбиталях, и общее число электронов на этом уровне не должно превышать 6.
Далее, на d-уровне, имеется пять орбиталей и максимальное количество электронов на этом уровне составляет 10. На последнем энергетическом уровне, f-уровне, имеется семь орбиталей и общее число электронов на этом уровне может быть равно 14.
Расположение электронов на энергетических уровнях определяет химические свойства атома. Взаимодействие атомов металлов с другими химическими веществами, в том числе с веществами в окружающей среде, зависит от количества и расположения электронов. Электроны на более близких к ядру энергетических уровнях обладают большей энергией и могут легко взаимодействовать с другими атомами и ионами.
Энергетические уровни и расположение электронов в атомах металлов являются важными для понимания их восстановительных свойств. Восстановление - это процесс передачи электронов от металла к другим веществам, что позволяет восполнять потерю электронов в реакциях окисления. Благодаря своей структуре и энергетическим уровням, атомы металлов могут эффективно участвовать в реакциях восстановления и способны образовывать ионы с положительным зарядом, которые сосредоточены в металлической матрице и способны передавать электроны другим веществам.
Особенности электронной оболочки

Электронная оболочка атома металла состоит из электронных орбиталей, на которых располагаются электроны. В металлах электронная оболочка отличается от оболочек атомов других элементов своей особенной структурой и особенностями связи электронов.
В оболочке металла преобладает несколько заполненных энергетических уровней, содержащих большое количество электронов. Это обуславливает их хорошую проводимость электричества и тепла. Электроны с высокими энергиями могут свободно двигаться по кристаллической решетке металла, образуя так называемое "электронное облако".
В металлах также можно наблюдать явление фермионного идеального газа, при котором свободные электроны движутся независимо друг от друга и не взаимодействуют между собой. Однако в отличие от идеального газа, в металлах существуют межэлектронные взаимодействия, что является причиной их специфических физических свойств, таких как пластичность, прочность и способность к восстановительным реакциям.
Электронная оболочка металлов также может образовывать смешанные и связанные состояния, что влияет на их электронную структуру и восстановительные свойства. Например, наличие свободных дырок — положительно заряженных мест в оболочке, позволяет металлам активно участвовать в реакциях окисления и восстановления, обеспечивая их способность к превращению одних веществ в другие.
Включение в решетку кристалла
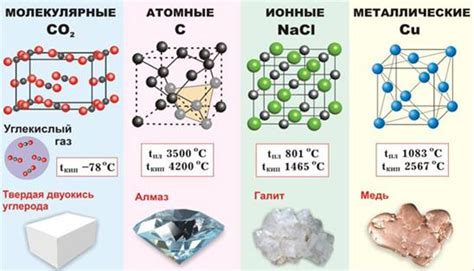
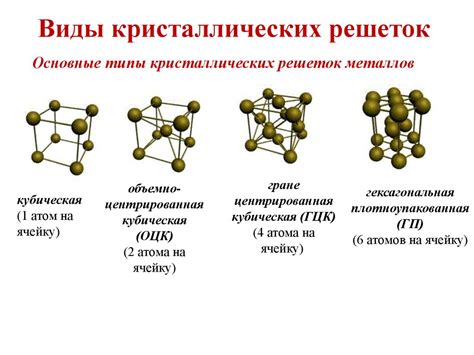
Атомы металлов обладают особенностями строения, которые позволяют им успешно встраиваться в кристаллическую решетку. Кристаллическая решетка представляет собой упорядоченную структуру, в которой атомы металлов занимают определенные позиции и взаимодействуют между собой.
Включение атомов металлов в решетку кристалла происходит благодаря особой связи между атомами. Каждый атом металла обладает внешними электронами, которые могут свободно перемещаться по решетке и создавать связи с другими атомами. Это обусловлено наличием свободных электронов в валентной оболочке атома, которые формируют так называемое "электронное облако".
Атомы металлов при включении в решетку кристалла занимают позиции в узлах этой решетки. Узлы решетки представляют собой точки пересечения трех или более атомов, где они образуют связи между собой. В результате образуется пространственная структура, которая обладает определенными свойствами, такими как прочность, упругость и проводимость электричества и тепла.
Различные металлы имеют разные характеристики своей решетки. Например, некоторые металлы образуют простую кубическую решетку, в которой атомы расположены на вершинах куба и в центре каждой грани. Другие металлы образуют сложные решетки, такие как гексагональная, гранецентрированная кубическая или основная кубическая.
Роль атомов металлов в каталитических процессах

Атомы металлов играют важную роль в каталитических процессах, которые являются ключевыми во многих химических реакциях. Каталитические процессы позволяют ускорить скорость химической реакции, не расходуя большое количество энергии. Ключевой особенностью атомов металлов является их способность служить активными центрами катализаторов.
Атомы металлов могут принимать участие в каталитических реакциях, действуя как сито для различных молекул и ионов. Это связано с их способностью принимать и отдавать электроны, что позволяет им взаимодействовать с другими веществами и изменять их химические свойства. Например, палладий и платина могут служить катализаторами в различных реакциях окисления и восстановления.
Атомы металлов также могут образовывать специфические поверхности, которые облегчают протекание реакции. Эти поверхности могут иметь различные формы, такие как поры или ямки, которые увеличивают площадь взаимодействия и обеспечивают более эффективную соприкосновение реагентов. Кроме того, атомы металлов могут притягивать определенные молекулы к себе, образуя комплексы, что способствует их превращению в более активные реагенты.
Таким образом, атомы металлов играют важную роль в каталитических процессах, обеспечивая активный центр для реакций и обладая специфическими свойствами, которые позволяют ускорить скорость химических превращений. Изучение и понимание этих особенностей атомов металлов позволяет разрабатывать более эффективные катализаторы и применять их в различных областях химии и промышленности.
Роль в передаче электронов
Атомы металлов обладают особыми свойствами в передаче электронов, что является одной из причин их высокой электропроводности и восстановительной активности.
В основе этих свойств лежит строение атома металла. У атома металла на внешнем энергетическом уровне находятся всего несколько электронов, что делает его нестабильным и стремящимся к достижению энергетического равновесия. Это приводит к тому, что атом металла готов передавать свои электроны другим атомам, чтобы достичь более стабильного состояния.
Передача электронов происходит в металлах благодаря особой структуре их кристаллической решетки. В металлической решетке атомы металла образуют сеть, в которой электроны могут свободно перемещаться. Это свободное движение электронов позволяет металлам быть хорошими проводниками электричества и тепла.
Кроме того, передача электронов способствует восстановительным свойствам металлов. Восстановление – это процесс передачи электрона от одного атома или молекулы к другому, что приводит к изменению окислительного состояния вещества. Благодаря способности металлов передавать электроны, они могут эффективно участвовать в восстановительных реакциях и обеспечивать течение электронных переносов.
Значение в восстановительных свойствах

Атомы металлов играют важную роль в восстановительных свойствах, так как они способны принимать и отдавать электроны. Это позволяет им участвовать в реакциях окисления-восстановления, которые являются основой многих химических процессов.
Металлы, благодаря своей структуре, обладают низкой электроотрицательностью, что означает, что они предпочитают отдавать электроны, чтобы достичь стабильной электронной конфигурации. Поэтому металлы легко окисляются, принимая участие в реакциях восстановления и способствуя восстановлению других веществ.
Первичная роль металлов в восстановительных свойствах проявляется в различных областях жизни. Например, металлы используются в процессе электролиза, где они являются восстановителями, отдавая электроны анодам. Это позволяет получать самые разные продукты, включая чистые металлы, кислород и хлор.
Кроме того, металлы используются в процессе гальванического покрытия, где они играют роль восстановителей, образуя покрытие из металлического слоя на поверхности другого металла. Это позволяет защитить металл от коррозии и придать ему дополнительные свойства, такие как повышенная твердость или электропроводность.
Также металлы применяются в различных реакциях в органической химии, где они способны восстановить соединения, содержащие двойные или тройные связи. Это позволяет получать различные органические продукты и синтезировать новые соединения с помощью металлических каталитических систем.
Вопрос-ответ

Какие особенности строения атомов металлов?
Атомы металлов имеют особую структуру, состоящую из ядра, в котором находятся протоны и нейтроны, и электронной оболочки, на которой расположены электроны. Ядро атома заряжено положительно, а электроны имеют отрицательный заряд. В металлах электроны внешней оболочки обладают большой подвижностью, что обуславливает их хорошую проводимость электричества и тепла.
Какое значение имеет электронная оболочка в строении атомов металлов?
Электронная оболочка в строении атомов металлов играет важную роль. Внешние электроны, находящиеся на этой оболочке, принимают участие в химических реакциях и определяют восстановительные свойства металлов. Благодаря свободным электронам, металлы способны легко отдавать электроны и образовывать положительные ионы. Это объясняет их способность к редукции других веществ и использованию в качестве восстановителей.
Почему металлы обладают хорошей проводимостью электричества?
Металлы обладают хорошей проводимостью электричества из-за особенностей строения их атомов. В металлах электроны внешней оболочки свободно движутся по кристаллической решетке. Это связано с тем, что электроны принадлежащие каждому атому, обмениваются свободно между собой. Таким образом, металлы обладают большой электропроводностью и могут легко передавать электрический ток.
Какова роль металлов в восстановительных свойствах?
Металлы играют важную роль в восстановительных свойствах из-за электронной структуры и свободных электронов на своей внешней оболочке. За счет своей способности отдавать электроны, металлы могут восстанавливать окисленные вещества, превращая их в ионы с меньшим зарядом или нейтральные атомы. Благодаря этому металлы часто используются в химических реакциях, где необходима сильная восстановительная способность.