Многие металлы образуют катионы при взаимодействии с хлором. Данное явление позволяет проводить различные химические реакции и создавать новые соединения. Катионы являются положительно заряженными и играют важную роль в реакциях с хлором.
Одним из наиболее распространенных катионов, образующихся при реакции металлов с хлором, является катион меди. Медный катион имеет формулу Cu2+ и образуется при взаимодействии меди с хлором. Этот катион широко применяется в различных индустриях, включая химическую, электрическую и легкую промышленность.
Еще одним примером катионов, образующихся при реакции металлов с хлором, являются катионы железа. Железные катионы Fe3+ и Fe2+ могут образовываться при окислении и редукции железа в присутствии хлора. Эти катионы широко используются в производстве стали, лекарств и косметических средств.
Интересно отметить, что при взаимодействии различных металлов с хлором образуются разные катионы. Например, натрий образует катион Na+, а алюминий образует катион Al3+. Это связано с различиями в химических свойствах металлов и их способности образовывать ионы.
Таким образом, образование катионов при реакции металлов с хлором играет важную роль в химических реакциях и создании новых соединений. Катионы меди и железа широко применяются в различных отраслях промышленности и имеют большое значение для нашей жизни.
Образование катионов

Когда металлы взаимодействуют с хлором, происходит образование катионов. Катионы представляют собой положительно заряженные ионы, которые образуются путем потери одного или нескольких электронов.
Образование катионов происходит из-за электроотрицательности хлора, который имеет большую аффинность к электронам. Когда металлический элемент взаимодействует с хлором, хлор забирает электроны у металла, образуя отрицательно заряженные анионы. В результате потери электронов металл становится положительно заряженным и образует катионы.
Катионы, образовавшиеся в результате взаимодействия металлов с хлором, играют важную роль во многих химических процессах. Например, они могут быть использованы в электрохимических реакциях или в качестве катализаторов. Катионы также могут участвовать в образовании солей и других химических соединений.
Образование катионов является одним из основных процессов, которые происходят при взаимодействии металлов с хлором. Этот процесс обусловлен химическими свойствами металлов и хлора, и может иметь значительное влияние на химические реакции, в которых участвуют эти вещества.
Единственный катион, имеющий одну зарядность

В результате взаимодействия различных металлов с хлором образуется целый ряд катионов с различной степенью зарядности. Однако среди них существует единственный катион, который имеет только одну зарядность - это катион гидрогена, или H+.
Катион гидрогена образуется при реакции металла с хлоридом водорода (HCl). Во время реакции металл отдаёт свои электроны хлору, образуется водород и образуется ион H+.
Катион гидрогена является одним из основных катионов в химических реакциях. Он играет важную роль в многих процессах, таких как растворение веществ, поддержание кислотно-щелочного баланса, участие в реакциях окисления и восстановления.
Как правило, катион гидрогена встречается в реакциях в виде иона водорода, в котором присутствует один протон и не имеет электронов. Это делает его положительно заряженным и помогает взаимодействию с отрицательно заряженными анциями.
Катионы, имеющие двойную зарядность

Взаимодействие металлов с хлором может привести к образованию катионов, которые имеют двойную зарядность. Такие катионы обычно образуются при окислительной реакции металла с хлорным агентом.
Один из примеров катионов с двойной зарядностью является ферроций Fe^2+. Этот катион образуется при взаимодействии железа с хлорными соединениями. Ферроций является важным компонентом в различных химических соединениях и используется в промышленности и лабораторных исследованиях.
Еще одним примером катиона с двойной зарядностью является медиций Cu^2+. Медиций образуется при взаимодействии меди с хлорными соединениями. Этот катион широко применяется в различных отраслях промышленности, включая электротехнику, металлургию и химию.
Научное и промышленное значение катионов с двойной зарядностью заключается в их способности образовывать стабильные соединения и участвовать в различных реакциях. Они могут быть использованы в процессе синтеза новых материалов, катализаторов и других веществ, которые имеют широкое применение в различных отраслях науки и промышленности.
Трехвалентные катионы
Трехвалентные катионы – это ионы металлов, которые при взаимодействии с хлором образуют трехзарядные катионы. Такие ионы обладают высоким уровнем окислительной активности.
Некоторые из трехвалентных катионов, которые могут образовываться в реакции с хлором:
- Алюминий (Al3+): образуются ионы AlCl3;
- Феррум (Fe3+): образуются ионы FeCl3;
- Хром (Cr3+): образуются ионы CrCl3;
- Индий (In3+): образуются ионы InCl3;
- Алюминий (Al3+): образуются ионы AlCl3;
Трехвалентные катионы обычно образуют стабильные ионные соединения с хлором, которые часто используются в различных отраслях промышленности и в научных исследованиях.
Однако, трехвалентные катионы могут также образовывать нестабильные соединения, которые обладают высокой реакционной способностью и способны вступать в химические реакции с другими веществами. Такие соединения могут использоваться в качестве катализаторов в различных химических процессах.
Четырехвалентные катионы
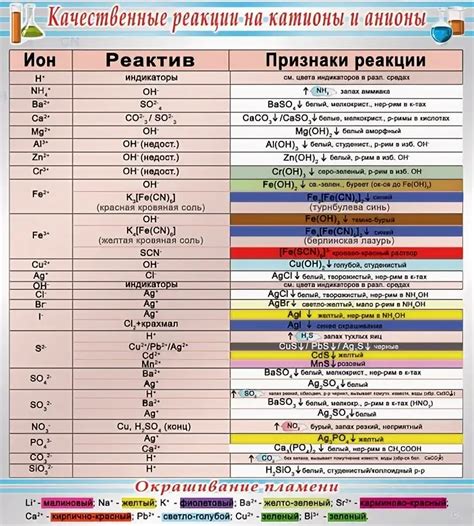
Взаимодействие металлов с хлором может приводить к образованию четырехвалентных катионов, которые обладают положительным зарядом +4. Такие катионы часто встречаются в химических соединениях, особенно вокруг переходных металлов.
Примером четырехвалентного катиона может служить титаний, который образует Ti(IV) катионы в хлорных соединениях. Они имеют химическую формулу Ti^4+, где знак ^4+ указывает на четырехвалентный характер катиона.
Другим примером является цирконий, который также формирует четырехвалентные катионы в хлорных соединениях. Они обозначаются как Zr^4+ и играют важную роль во многих процессах, таких как производство сплавов и керамики.
Четырехвалентные катионы обладают высокой степенью окислительной активности и могут образовывать устойчивые соединения с отрицательно заряженными анионами. Их свойства и реактивность играют важную роль во многих химических процессах и применениях, включая катализ и электрохимические реакции.
В целом, четырехвалентные катионы представляют собой важную группу химических соединений, которые имеют широкий спектр приложений в различных отраслях химии и промышленности.
Пяти- и шестивалентные катионы
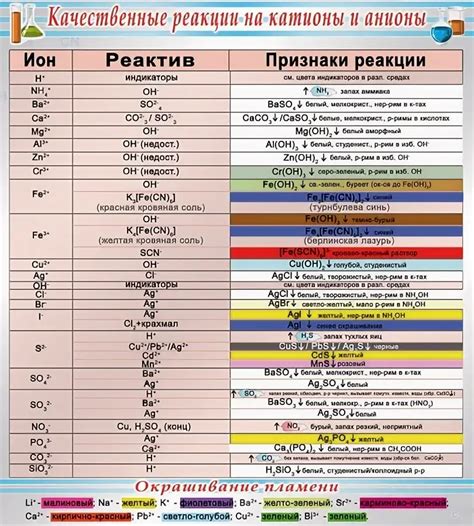
При взаимодействии металлов с хлором образуются различные катионы, имеющие разную степень окисления. Одними из наиболее распространенных катионов являются пяти- и шестивалентные катионы. Пятивалентный катион представляет собой ион, в котором металл имеет степень окисления +5, а шестивалентный катион - ион, в котором степень окисления металла составляет +6.
Пяти- и шестивалентные катионы обладают различными свойствами и имеют разное влияние на окружающую среду. Например, пятивалентный катион может образовываться при окислении двухвалентного катиона в присутствии хлора. Этот процесс может происходить при нагревании или контакте с окислителями.
Шестивалентные катионы образуются при окислении пятивалентного катиона или в результате соответствующих реакций с окислителями. Важно отметить, что шестивалентные катионы могут быть более реакционноспособными и токсичными по сравнению с пятивалентными.
Пяти- и шестивалентные катионы могут присутствовать в природных материалах, а также образовываться в процессе химических реакций и промышленных процессах. Например, ионы пятивалентных и шестивалентных металлов могут содержаться в воде, почве, минералах и других природных средах. Также они могут быть образованы в результате окисления металлов в атмосфере или при взаимодействии с химическими веществами.
Другие катионы, образующиеся взаимодействием металлов с хлором

Кроме хлорида металла, в реакциях взаимодействия металлов с хлором могут образовываться различные катионы, которые играют важную роль в химических процессах и имеют различные свойства.
Один из таких катионов - аммоний (NH4+). Взаимодействие хлорида аммония с металлами приводит к образованию соответствующих солей, содержащих аммоний-катион. Аммоний-катион обладает амфотерными свойствами и способен образовывать хлориды, сульфаты, нитраты и другие соединения.
Еще одним важным катионом, образующимся в реакциях с хлором, является калий (K+). Многие металлы, такие как железо, медь, цинк, алюминий и др., могут реагировать с хлористым калием, образуя соответствующие хлориды металла с калием в виде растворов или осадков. Катион калия имеет положительный заряд и является сильным окислителем.
Также стоит упомянуть катион магния (Mg2+), который образуется при взаимодействии хлорида магния с металлами. Хлорид магния широко используется в промышленности и в медицине. Катион магния обладает важными физиологическими свойствами и играет значительную роль в метаболических процессах организма.
Таким образом, взаимодействие металлов с хлором может приводить к образованию различных катионов, которые имеют различные свойства и широко применяются в различных отраслях науки и промышленности.
Участие катионов в химических реакциях
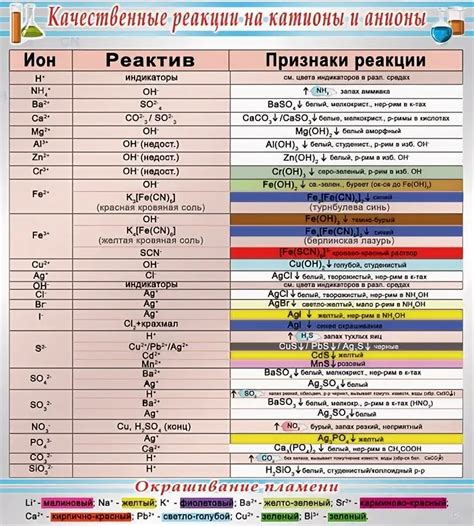
Катионы, образующиеся взаимодействием металлов с хлором, могут активно участвовать в различных химических реакциях. Их присутствие может значительно влиять на ход этих реакций и образование новых соединений.
Во-первых, катионы могут образовывать соли с отрицательно заряженными анионами. Установление ионной связи между катионами и анионами приводит к образованию кристаллических соединений, таких как хлориды металлов. Эти соединения имеют различные свойства и могут использоваться в различных отраслях промышленности и научных исследованиях.
Во-вторых, катионы могут участвовать в реакциях окисления и восстановления. Один из примеров такой реакции - реакция образования окиси металла. При этом катионы металла могут участвовать в переносе электронов, что приводит к образованию оксида металла.
Кроме того, катионы могут образовывать комплексные соединения с различными лигандами. Эти соединения могут иметь сложную структуру и обладать различными свойствами. Комплексные соединения могут использоваться в качестве катализаторов, сенсибилизаторов или ингибиторов в различных химических процессах.
Таким образом, участие катионов, образующихся взаимодействием металлов с хлором, в химических реакциях является важным фактором, определяющим свойства и возможные применения этих соединений. Взаимодействие катионов с анионами, реакции окисления и восстановления, а также образование комплексных соединений открывают широкие возможности для исследований и применения в различных областях науки и промышленности.
Применение катионов в промышленности и научных исследованиях
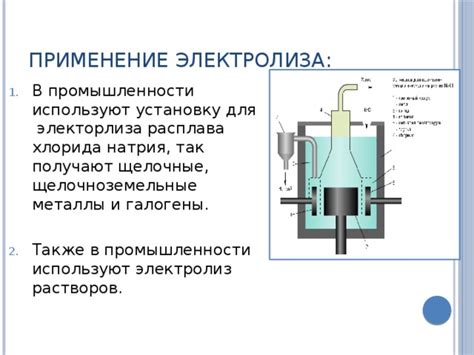
Катионы, образующиеся в результате взаимодействия металлов с хлором, широко применяются в различных отраслях промышленности и научных исследованиях. Они обладают уникальными свойствами, которые позволяют использовать их в разных целях.
Одним из основных применений катионов в промышленности является использование их в процессе электролиза. Катионы металлов, такие как медь, никель, цинк и другие, используются в процессах гальванизации, электрохимического осаждения и электролитической обработки поверхности различных изделий. Эти процессы нашли широкое применение в разных отраслях промышленности, включая производство автомобилей, электронику, строительство и другие. Катионы металлов используются для создания прочных и устойчивых покрытий на поверхностях разных материалов, что позволяет улучшить их качество и защитить от коррозии.
Другим важным применением катионов в промышленности является их использование в процессе катализа. Катионы некоторых металлов, таких как платина, родий, палладий, обладают высокими катализаторными свойствами и используются в химической промышленности для ускорения химических реакций. Они применяются в процессах синтеза органических соединений, очистки отходов и воздуха, производства пластмасс и много других сферах. Катионы металлов играют важную роль в снижении затрат энергии и времени на промышленные процессы и в создании более эффективных и экологически чистых технологий.
Наконец, катионы металлов широко используются в научных исследованиях и разработке новых материалов. Катионы обладают специфическими химическими свойствами, которые могут быть использованы для создания новых материалов с уникальными электрическими, магнитными и оптическими свойствами. Они применяются в исследованиях в области нанотехнологий, создания новых сплавов, полупроводниковых материалов и других областей науки и техники. Такие исследования помогают развивать новые технологии и материалы, которые могут найти применение в разных отраслях промышленности и повысить эффективность различных процессов.
Вопрос-ответ

Какие металлы могут образовывать катионы при взаимодействии с хлором?
Многие металлы могут образовывать катионы при взаимодействии с хлором, например, натрий, калий, магний, цинк и другие.
Какие свойства имеют катионы, образующиеся при взаимодействии металлов с хлором?
Катионы, образующиеся при взаимодействии металлов с хлором, обычно имеют положительный заряд, так как теряют один или несколько электронов. Они также могут обладать различными физическими и химическими свойствами в зависимости от металла и условий реакции.
Каким образом происходит образование катионов при взаимодействии металлов с хлором?
Взаимодействие металлов с хлором происходит через обмен электронами. Металл отдает один или несколько электронов атому хлора, что приводит к образованию положительно заряженного катиона металла и отрицательно заряженного аниона хлора.
В каких соединениях могут находиться катионы, образующиеся при взаимодействии металлов с хлором?
Катионы, образующиеся при взаимодействии металлов с хлором, могут находиться в различных соединениях, таких как хлориды, соли и комплексы. Например, образуются хлориды металлов, такие как хлорид натрия, хлорид калия и др.
Какова роль катионов, образующихся при взаимодействии металлов с хлором, в химических реакциях?
Катионы, образующиеся при взаимодействии металлов с хлором, могут играть различные роли в химических реакциях. Например, они могут участвовать в обменных реакциях, реагировать с другими веществами, образуя новые соединения или служить катализаторами для других химических превращений.
