Металлы являются важными реагентами в химических реакциях и находят широкое применение во многих отраслях промышленности. Один из важных аспектов взаимодействия металлов в химических реакциях - это их способность реагировать с карбоновыми кислотами, особенно сильными кислотами, такими как сульфурная и соляная кислоты.
Металлы различаются по своей реакционной активности с карбоновыми кислотами. Например, щелочные металлы, такие как натрий и калий, очень активно реагируют с карбоновыми кислотами, образуя соли и выделяя газ. Интересно отметить, что реакция натрия или калия с карбоновыми кислотами может быть настолько сильной, что может привести к взрыву или возгоранию.
Однако не все металлы так активно реагируют с карбоновыми кислотами. Например, металлы второй и третьей группы периодической системы, такие как магний и алюминий, реагируют с карбоновыми кислотами значительно медленнее. Это связано с их более низкой реакционной активностью и стабильностью оксидных пленок на их поверхности, которые предотвращают полное взаимодействие с кислотой.
Взаимодействие карбоновых кислот с металлами
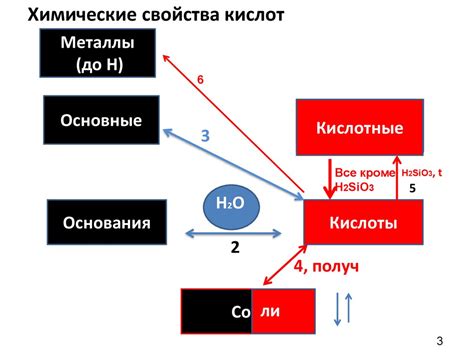
Взаимодействие карбоновых кислот с металлами является одной из основных реакций в органической химии. Карбоновые кислоты содержат карбоксильную группу (-COOH), которая является активным центром для взаимодействия с металлами.
Некоторые металлы, такие как щелочные металлы (например, натрий, калий) и щелочноземельные металлы (например, магний, кальций), активно реагируют с карбоновыми кислотами. Эти реакции приводят к образованию солей карбоновых кислот, которые обладают различными свойствами и широко используются в химической промышленности.
Некоторые металлы, такие как алюминий и цинк, также могут реагировать с карбоновыми кислотами, образуя комплексные соединения. Эти комплексы обладают различными физическими и химическими свойствами и находят применение в различных областях, включая катализ и изготовление материалов.
Взаимодействие карбоновых кислот с металлами имеет большую важность как в академической науке, так и в промышленности. Изучение этих реакций позволяет развивать новые методы синтеза органических соединений, создавать новые материалы с улучшенными свойствами и оптимизировать процессы производства с использованием этих реакций.
Какие металлы активно реагируют?

Многие металлы проявляют активность при взаимодействии с карбоновыми кислотами. Эта реакция происходит за счет образования солей, которые могут быть как растворимыми, так и нерастворимыми в воде. Некоторые металлы активно реагируют с карбоновыми кислотами и могут даже приводить к выделению пузырей газа.
Наиболее активными металлами при реакции с карбоновыми кислотами являются щелочные и щелочноземельные металлы. К ним относятся литий, натрий, калий, магний, кальций и др. Эти металлы образуют растворимые соли, которые хорошо растворяются в воде. Реакция между карбоновыми кислотами и щелочными или щелочноземельными металлами может происходить с выделением тепла и при образовании газового пузырька.
Однако не все металлы активно реагируют с карбоновыми кислотами. Например, металлы из группы платины (платина, палладий, родий) обладают малым уровнем активности и практически не взаимодействуют с карбоновыми кислотами. Также некоторые транситные металлы (такие как железо, медь, цинк) проявляют некоторую активность, но реакция с карбоновыми кислотами может быть медленной или требовать специальных условий.
Платиновые металлы и их взаимодействие с карбоновыми кислотами

Платиновые металлы, такие как платина, палладий и родий, проявляют высокую активность во взаимодействии с карбоновыми кислотами. Это связано с их специфической электронной конфигурацией и способностью образовывать комплексы с карбоновыми кислотами.
Взаимодействие платиновых металлов с карбоновыми кислотами обусловлено образованием химических связей между металлом и функциональной группой карбоновой кислоты, такой как карбоксильная группа COOH. При этом образуется комплексный ион или комплексное соединение, в котором карбоновая кислота становится координированным лигандом к платиновому металлу.
Платиновые металлы могут образовывать различные типы комплексов с карбоновыми кислотами. Например, платина может образовывать комплексы с одной карбоновой кислотой или с несколькими карбоновыми кислотами одновременно. Также платиновые металлы могут образовывать комплексы, в которых карбоновая кислота является частью полинуклеарного комплекса, содержащего несколько платиновых металлов.
Подобные комплексы платиновых металлов с карбоновыми кислотами имеют множество применений. Они могут использоваться, например, в качестве катализаторов в реакциях окисления карбоновых кислот или в процессе синтеза органических соединений. Кроме того, эти комплексы обладают интересными физическими и химическими свойствами, что делает их перспективными для исследования в различных областях науки и техники.
Реакция железа и его сплавов с карбоновыми кислотами

Железо и его сплавы, такие как сталь и чугун, могут активно реагировать с карбоновыми кислотами. Эти реакции основаны на способности железа образовывать комплексы с карбоксильными группами, которые присутствуют в структуре карбоновых кислот.
Один из основных типов реакций, которые могут происходить между железом и карбоновыми кислотами, - это образование солей. Когда карбоновая кислота реагирует с железом, образуется соль карбоната или акетата железа, в зависимости от условий реакции.
Однако, реакция между железом и карбоновыми кислотами может быть сложнее, особенно в присутствии других веществ или при изменении условий реакции. Например, при наличии кислорода воздуха и влаги, железо может реагировать с карбоновыми кислотами, образуя ржавчину.
Важно отметить, что реакция между железом и карбоновыми кислотами может зависеть от концентрации и типа кислоты, а также от температуры и времени реакции. Поэтому, перед проведением экспериментов необходимо учитывать все эти факторы и проводить необходимые контрольные мероприятия.
Различные исследования показали, что реакция железа и его сплавов с карбоновыми кислотами может быть полезна в различных областях, таких как промышленность, медицина и наука. Например, комплексы железа с карбоновыми кислотами могут использоваться в качестве катализаторов реакций, а также в синтезе органических соединений.
Авокадо: идеальное решение для хранения карбоновых кислот

Авокадо – это не только популярный продукт питания, но и идеальное решение для хранения карбоновых кислот. Карбоновые кислоты, такие как уксусная, являются важными компонентами во многих химических реакциях, и их сохранность при хранении играет ключевую роль.
Авокадо обладает высокой естественной кислотностью и богатое содержание жирных кислот, что является преимуществом при хранении карбоновых кислот. Жирные кислоты помогают стабилизировать pH-уровень и предотвращать окисление карбоновых кислот.
Кроме того, авокадо содержит обильное количество антиоксидантов, которые помогают защитить карбоновые кислоты от деградации. Они уменьшают активность свободных радикалов, которые могут повредить карбоновые кислоты, и способствуют сохранности их химических свойств.
Интересно отметить, что авокадо также обладает способностью абсорбировать и удерживать воду, что делает его отличным вариантом для хранения карбоновых кислот, которые могут быть чувствительны к влажности.
В заключение, авокадо представляет собой идеальное решение для хранения карбоновых кислот благодаря своей высокой кислотности, содержанию жирных кислот, антиоксидантам и своей способности удерживать влагу. Этот фрукт является надежным и эффективным способом обеспечить сохранность и стабильность карбоновых кислот на протяжении длительного времени.
Сурьма и ее реакция с карбоновыми кислотами
Сурьма - это химический элемент с атомным номером 51 и символом Sb. Он является полуметаллом и имеет множество применений в различных областях, включая производство полупроводников, пигментов и лекарств.
Сурьма активно взаимодействует с карбоновыми кислотами, образуя соли сурьмы. Этот процесс называется карбоксилатированием. Карбоновые кислоты, содержащие карбоксильные группы (-COOH), реагируют с металлическим атомом сурьмы, образуя соль карбоновой кислоты и освобождая молекулы воды.
Реакция сурьмы с карбоновыми кислотами обычно происходит при нагревании и в присутствии соответствующего катализатора. Каталитическое воздействие помогает активировать металл и позволяет более эффективно протекать реакции с карбоновыми кислотами.
Соли сурьмы, образованные в результате реакции с карбоновыми кислотами, обладают различными свойствами и могут использоваться в качестве катализаторов, пигментов и других химических соединений.
Важно отметить, что активность реакции сурьмы с карбоновыми кислотами может варьироваться в зависимости от конкретных условий, в которых происходит реакция. Также стоит учесть, что взаимодействие сурьмы с карбоновыми кислотами не является единственным возможным типом реакции с участием этого металла.
Титан и его активность во взаимодействии с карбоновыми кислотами

Титан является одним из наиболее активных металлов во взаимодействии с карбоновыми кислотами. Это связано с его химическими свойствами и способностью образовывать стабильные соединения с этими органическими веществами.
Взаимодействие титана с карбоновыми кислотами приводит к образованию титановых солей, которые представляют собой сложные соединения, содержащие катион титана и анион кислоты. Эти соли обладают разнообразными свойствами и могут использоваться в различных отраслях промышленности, таких как катализ, керамика, лакокрасочная промышленность и других.
Активность титана во взаимодействии с карбоновыми кислотами определяется его способностью образовывать координационные связи с атомами кислорода в молекулах кислоты. Такие связи приводят к стабилизации и активации молекулы кислоты, что позволяет титану успешно взаимодействовать с ними.
Особенно активным взаимодействием титана с карбоновыми кислотами является образование основных титанатов, в которых катион титана образует комплексы с анионами кислоты. Это обладает большим значением для различных химических процессов, так как позволяет использовать реакцию взаимодействия металла и кислоты как катализатор или инициатор ряда химических превращений.
Взаимодействие алюминия и карбоновых кислот: что ждать?
Алюминий - один из самых распространенных металлов на Земле, и он активно взаимодействует с карбоновыми кислотами. Карбоновые кислоты образуют насыщенные и ненасыщенные соединения, содержащие одну или несколько карбоксильных групп. Алюминий обладает высокой реакционной способностью и может вступать в химическое соединение с карбоновыми кислотами.
В результате реакции альдегидных и кетонных групп карбоновых кислот с алюминием образуются алюминийорганические соединения. Эти соединения могут иметь различную физическую и химическую природу и широко применяются в различных областях науки и промышленности.
Одним из наиболее известных соединений алюминия с карбоновыми кислотами является спингельсол (алюминийовая соль уксусной кислоты). Это бесцветные кристаллы, которые имеют широкий спектр применения, включая использование в пищевой промышленности как консервант и стабилизатор, а также в производстве керамических и стеклянных материалов.
Также алюминий может образовывать комплексные соединения с карбоновыми кислотами, такие как алюминоксохелаты. Эти соединения обладают особыми свойствами и используются в качестве катализаторов, фоточувствительных веществ и в других сферах применения.
Взаимодействие алюминия и карбоновых кислот имеет большое значение в химической и промышленной отраслях, поскольку позволяет получать различные соединения с определенными физико-химическими свойствами. Оно также изучается в научных исследованиях с целью разработки новых материалов и технологий.
Вопрос-ответ

Какие металлы активно реагируют с карбоновыми кислотами?
Карбоновые кислоты могут активно реагировать с металлами, такими как натрий, калий, алюминий, цинк, магний, железо и многими другими. Реакция зависит от реактивности металлов и специфических свойств карбоновых кислот.
Какие свойства металлов влияют на их взаимодействие с карбоновыми кислотами?
Свойства металлов, такие как электроотрицательность, размеры и энергия ионизации, могут влиять на их взаимодействие с карбоновыми кислотами. Более электроотрицательные металлы, такие как натрий и калий, обычно более активно реагируют с карбоновыми кислотами.
