Щелочные ответы имеют широкое применение в различных отраслях нашей жизнедеятельности. Они используются в бытовых, научных и промышленных целях. Чтобы понять, какие металлы составляют основу щелочных растворов, необходимо изучить их характеристики и свойства. В данной статье будут рассмотрены наиболее популярные и широко используемые металлы в составе щелочных ответов.
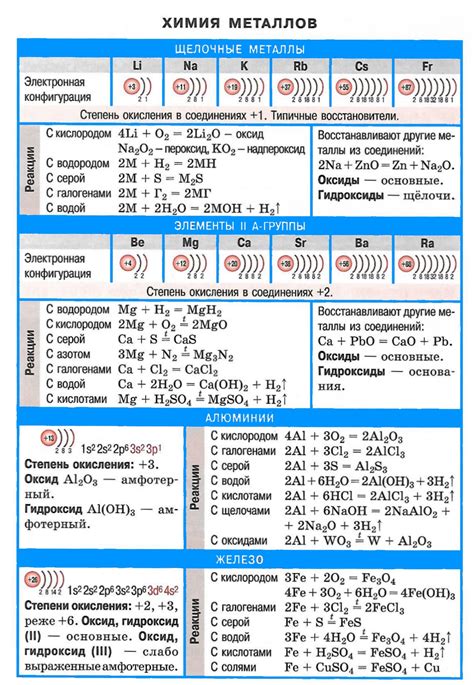
Первым металлом, который стоит отметить, является натрий. Он является основным компонентом щелочи и широко применяется в химическом производстве, в производстве мыла и в промышленности стекла. Натрий обладает высокой химической активностью, что делает его неотъемлемой частью многих щелочных растворов.
Вторым важным металлом, который входит в состав щелочных ответов, является калий. Калий используется в медицине, сельском хозяйстве и промышленности. Он является необходимым элементом для нормального функционирования организма, поэтому представляет огромный интерес для фармацевтической отрасли. Калий также используется для удобрения почвы и повышения его плодородия в сельском хозяйстве.
Еще одним важным металлом, присутствующим в щелочных ответах, является литий. Он имеет широкое применение в электротехнике, промышленности стекла и керамики, а также в фармацевтической отрасли. Литий обладает высокой электропроводностью и високим уровнем термической стабильности, что делает его незаменимым материалом для производства различных изделий и устройств.
Металлы, составляющие щелочные растворы: перечень и свойства
Щелочные растворы, также известные как щелочи, содержат в своем составе металлы из группы щелочных металлов. Эта группа включает в себя литий, натрий, калий, рубидий, цезий и франций. Щелочные металлы имеют сходные свойства и являются активными химическими элементами.
Первый элемент этой группы - литий (Li) - является самым легким металлом. Он обладает высокой активностью и хорошей электропроводностью. Литий образует щелочные растворы, которые обладают щелочными свойствами: они хорошо растворяются в воде, образуя щелочные ионы.
Натрий (Na) - второй элемент группы щелочных металлов. Он также обладает высокой активностью и применяется в качестве щелочи во многих промышленных процессах. Натрий образует щелочные растворы, которые имеют основные свойства и используются в быту, например, в качестве моющих средств и отбеливателей.
Калий (K) - следующий металл в группе щелочных металлов. Калий имеет схожие свойства с литием и натрием. Он также образует щелочные растворы, которые обладают щелочными свойствами. Калий широко используется в сельском хозяйстве для удобрений.
Рубидий (Rb), цезий (Cs) и франций (Fr) - последние элементы группы щелочных металлов. Они также обладают химическими свойствами щелок и образуют щелочные растворы. Рубидий и цезий широко используются в научных и исследовательских целях.
Общими свойствами металлов группы щелочных металлов являются высокая активность, хорошая электропроводность и способность образовывать щелочные растворы. Эти растворы обладают основными свойствами и широко применяются в различных областях науки, техники и быта.
Литий: основные характеристики и применение
Литий – это химический элемент, относящийся к щелочным металлам. Он обладает атомным номером 3 и символом Li. Литий – легкий металл серебристо-белого цвета, который обладает высокой химической реактивностью и низкой плотностью. Он обладает низкой температурой плавления и кипения, что делает его одним из самых легких металлов в таблице Менделеева.
Литий имеет ряд уникальных характеристик и свойств, которые делают его ценным в различных отраслях промышленности и науки. Во-первых, литий является очень реактивным металлом, поэтому его часто используют в производстве аккумуляторов и батарей. Он обладает высокой энергетической плотностью и долгим сроком службы, что делает его идеальным для использования в электромобилях и портативных устройствах.
Кроме того, литий используется в производстве стекол и керамики благодаря своей способности придавать им фоточувствительность. Он также применяется в производстве легких сплавов, которые используются в авиации и космической промышленности, так как они обладают высокой прочностью и легкостью.
Литий является одним из ключевых элементов для развития исследований в области ядерной энергетики. Ион лития используется в термоядерных реакторах для получения энергии путем ядерного синтеза. Благодаря своим уникальным свойствам, литий также применяется в медицине для лечения биполярных расстройств и других психических заболеваний.
Натрий: свойства и применение в нашей жизни

Натрий – это металлический элемент из группы щелочных металлов, отличающийся своими уникальными свойствами и широким применением в различных сферах жизни.
Одной из главных характеристик натрия является его активность. Он очень реактивен и легко вступает во взаимодействие с кислородом и водой. Именно благодаря этому свойству натрий широко применяется в производстве различных химических соединений.
Натрий находит применение в производстве щелочей, таких как гидроксид натрия (известный также как каустическая сода) и карбонат натрия (обычно называемый пищевой содой). Эти вещества используются в производстве мыла, стекла, моющих средств и других промышленных продуктов.
Благодаря своей стабильности натрий также широко используется в пищевой промышленности. Он не только служит добавкой для придания пищевым продуктам соленого вкуса, но и выполняет ряд технологических функций, таких как регулирование pH-баланса, участие в реакциях разрыхления теста и предупреждение образования бактерий.
Кроме того, натрий применяется в медицине. Натриевые растворы используются для инфузий и регулирования уровня электролитов в организме. Также натрий входит в состав некоторых лекарственных препаратов, используемых при лечении сердечно-сосудистых заболеваний и депрессии.
В заключение, натрий – это металлический элемент, обладающий рядом уникальных свойств, которые находят широкое применение в различных сферах нашей жизни. Он играет значительную роль в производстве химических соединений, пищевой промышленности и медицине, делая нашу жизнь более комфортной и здоровой.
Калий: химические свойства и использование в различных отраслях
Калий является одним из основных элементов, принадлежащих к классу щелочных металлов. Он обладает химическим символом K и атомным номером 19. Калий характеризуется низкой плотностью и мягкостью, что делает его легким для обработки и использования.
Одним из основных химических свойств калия является его взаимодействие с водой. При контакте с водой происходит быстрая реакция, сопровождающаяся выделением водорода и образованием щелочного раствора. Также калий обладает способностью окисляться на воздухе, что приводит к образованию оксидной пленки на поверхности металла.
Благодаря своим уникальным химическим свойствам, калий находит широкое применение в различных отраслях. В частности, щелочный раствор калия используется в производстве удобрений. Калий является необходимым элементом для роста растений и улучшения качества почвы. Благодаря своей способности удерживать влагу и обеспечивать хорошую вентиляцию корневой системы, калий повышает урожайность сельскохозяйственных культур.
Кроме того, калий широко используется в производстве различных видов стекла. Благодаря своей способности понижать температуру плавления стекла и улучшать его оптические свойства, калий играет важную роль в производстве стеклопродукции. Также калий применяется в производстве щелочных батарей, пиротехники, а также в лабораторных условиях для получения щелочных растворов и других химических соединений.
Рубидий: уникальные свойства и области применения

Рубидий является химическим элементом, относящимся к группе щелочных металлов. Этот металл получил свое название от латинского слова "rubidus", что означает "темно-красный". Особенностью рубидия является его низкая плотность, которая делает его легким и хорошо поддающимся обработке.
Одним из уникальных свойств рубидия является его способность восстанавливать себя после окисления на воздухе. Это позволяет использовать рубидий в качестве катализатора в различных химических процессах, включая производство пластмасс и катализаторы для синтеза органических соединений.
Другое важное свойство рубидия - его высокая электропроводность. Благодаря этому свойству рубидий широко используется в электронике, в частности, в производстве полупроводниковых приборов. Также рубидий применяется в различных приборах, например, виртуальных очках, благодаря своей способности создавать электромагнитное поле низкой частоты.
Кроме того, рубидий используется в ядерной энергетике. Он может быть использован в качестве рабочего вещества в теплоносителях в ядерных реакторах. Это обусловлено высокой способностью рубидия поглощать нейтроны и устойчивостью к радиационным воздействиям.
В заключение, рубидий обладает рядом уникальных свойств, которые делают его востребованным в различных областях промышленности. Он может быть использован в химических процессах, в электронике, в ядерной энергетике и других сферах, где требуется высокая электропроводность и способность катализировать химические реакции.
Цезий: основные характеристики и применение в научных исследованиях

Цезий – химический элемент периодической системы с атомным номером 55 и символом Cs. Он относится к группе щелочных металлов и обладает рядом характеристик, которые делают его уникальным в научных исследованиях.
Одной из ключевых особенностей цезия является его высокая реактивность. Благодаря этому свойству, цезий широко применяется в атомных исследованиях, включая работу со спектрометрами, радиоактивными изотопами и электронными приборами.
Цезий также обладает уникальными оптическими свойствами. В частности, он является одним из ключевых элементов в оптических часах и лазерных системах. Благодаря этим свойствам, цезий находит применение в точных измерениях времени и в научных экспериментах, связанных с исследованием световых явлений и спектроскопии.
Необходимо отметить, что цезий также широко применяется в различных исследованиях в области плазмафизики, атомной физики и физики конденсированного состояния. Его использование позволяет исследователям получать новые знания о структуре материи, свойствах электронов и многих других физических процессах.
Франций: редчайший металл и его возможные приложения

Франций - химический элемент, который входит в состав щелочных металлов. Он был открыт в 1939 году французским ученым Андре-Мари Амеде Бранли в результате исследований минерала лепидолита. Франций является одним из самых редких и труднодоступных металлов в мире.
Основное свойство франция - это его крайняя реактивность. Он очень быстро реагирует с водой, воздухом и многими другими веществами. Из-за этого он практически не встречается в природе. Франций можно получить исключительно путем синтеза в лабораторных условиях.
Из-за своей редкости и труднодоступности, франций не имеет широкого промышленного применения. Однако, он используется в научных исследованиях и экспериментах, где требуется исследование свойств щелочных металлов. Также франций может применяться в некоторых высокотехнологичных областях, таких как производство полупроводников и ядерная энергетика.
В целом, франций - это уникальный металл, который из-за своей редкости имеет ограниченное применение. Несмотря на это, он продолжает привлекать внимание ученых и исследователей своими необычными свойствами и потенциальными приложениями в различных областях.
Технеций: химические свойства и использование в ядерной индустрии

Технеций - радиоактивный химический элемент переходной группы, который широко используется в ядерной индустрии. Он имеет атомный номер 43 и обозначается символом Tc.
Химические свойства технеция в значительной степени определяются его радиоактивностью. Этот металл является активным катализатором и может взаимодействовать с различными веществами, образуя разнообразные соединения. Он хорошо растворяется в кислотах и реагирует с большинством других элементов.
Помимо обычных химических свойств, технеций обладает также и радиоактивными свойствами. Существует несколько изотопов этого элемента с различной степенью радиоактивности. Некоторые изотопы технеция могут использоваться в медицине для радиоизотопной диагностики и радиотерапии определенных заболеваний.
Использование в ядерной индустрии является одним из основных применений технеция. Он используется в ядерных реакторах для производства других радиоактивных изотопов, которые потом используются в медицине и других областях науки. Технеций также может быть использован для создания искусственных радиоактивных источников, которые находят применение в промышленности и научных исследованиях.
Однако несмотря на полезные свойства технеция, его широкое использование вызывает опасения в связи с его радиоактивностью. Продолжаются исследования по разработке новых способов использования и утилизации технеция, чтобы минимизировать его негативное воздействие на окружающую среду и человека.
Полоний: опасный металл и его роль в медицине и науке

Полоний – это радиоактивный химический элемент, который входит в группу металлов, входящих в состав щелочных ответов. Он представляет опасность для человеческого организма из-за его высокой радиоактивности и токсичности. Полоний обладает несколькими изотопами, но наиболее известными являются полоний-210 и полоний-214.
Полоний-210 имеет период полураспада около 138 дней и является альфа-излучателем. Получение полония-210 происходит путем облучения бисмута-209 нейтронами. Этот изотоп широко используется в науке и индустрии: его используют для статического электричества, X-лучей и промышленного исследования наноматериалов.
Однако, полоний также используется в медицине. В низких дозах полоний-210 применяется в радиоиммунотерапии для лечения определенных видов рака. Когда полоний-210 присоединяется к антителам, оно может доставлять радиоактивное вещество прямо к опухоли, что способствует ее уничтожению. Это позволяет снизить побочные эффекты радиационной терапии и улучшить эффективность лечения.
В заключение, полоний является опасным металлом, который требует особой осторожности при обращении с ним. Его высокая радиоактивность делает его потенциально вредным для человеческого здоровья. Однако, благодаря своим свойствам, полоний также находит свое применение в науке и медицине, где он используется для различных целей, включая насморк и радиоиммунотерапию.
Вопрос-ответ

Какие металлы входят в состав щелочных ответов?
В состав щелочных ответов входят следующие металлы: литий, натрий, калий, рубидий, цезий и франций. Все они относятся к металлам первой группы периодической системы элементов.
Какие свойства имеют металлы, входящие в состав щелочных ответов?
Металлы щелочных ответов обладают следующими свойствами: высокая электроотрицательность, маленькая ионная радиус, низкая плотность, низкая температура плавления и кипения, высокая термическая и электрическая проводимость. Они также реагируют с водой, образуя щелочные растворы.
