Металлы – это один из основных классов веществ, обладающих высокой электропроводностью и характерной металлической структурой. Они широко применяются в различных отраслях промышленности и строительства, благодаря своим уникальным свойствам и механическим характеристикам. В зависимости от своих свойств, металлы делятся на переходные и непереходные.
Непереходные металлы – это те металлы, у которых d- или f-электронные оболочки полностью заполнены или практически заполнены. Они также обладают высоким плавлением и кипением, хорошей термической и электрической проводимостью, а также устойчивостью к коррозии и окислению. К непереходным металлам относятся такие элементы, как медь (Cu), серебро (Ag), золото (Au), алюминий (Al) и ртуть (Hg).
Каждый из этих металлов имеет свои уникальные свойства и применения. Медь, например, используется в электротехнике, металлургии и строительстве благодаря своей высокой электропроводности. Серебро часто применяется в ювелирном деле и медицине, благодаря своей антимикробной и антиаллергенной активности. Золото является одним из самых драгоценных металлов и широко используется в ювелирном и финансовом секторах. Алюминий – легкий и прочный металл, который активно применяется в авиационной и автомобильной промышленности. Ртуть уникальна своим низким температурным плавлением и применяется в различных научных и технических областях.
Металлы, не образующие ионы: какие элементы входят в эту категорию?

Металлы, не образующие ионы, включают в себя такие элементы как медь (Cu), серебро (Ag) и золото (Au). Они относятся к группе непереходных металлов и обладают особым свойством - они не образуют положительно заряженные ионы при химических реакциях.
Медь (Cu) является одним из наиболее известных металлов, не образующих ионы. Она обладает высокой электропроводностью и используется в производстве электрических проводов, а также в производстве монет и украшений. Серебро (Ag) также является непереходным металлом и отличается высокой рефлективностью света.
Золото (Au) - еще один металл, не образующий ионы. Оно имеет характерный желтый цвет и используется в ювелирном деле и в качестве инвестиционного актива. Золото также имеет высокую устойчивость к окислению и коррозии, что делает его ценным материалом для производства ювелирных изделий и монет.
В целом, металлы, не образующие ионы, имеют уникальные свойства и широкий спектр применений. Их отличительной особенностью является отсутствие образования ионов в растворах и химических реакциях, что делает их важными компонентами в различных отраслях промышленности и научных исследований.
Понятие непереходных металлов
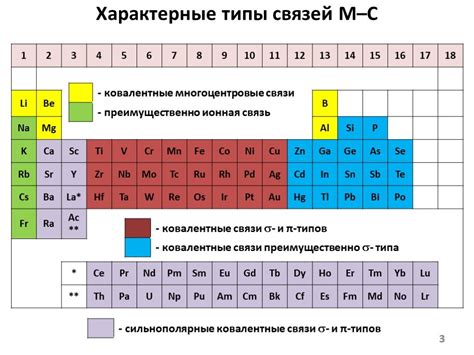
Непереходные металлы - это группа химических элементов, которые имеют характерные металлические свойства, но не образуют ионы с положительным зарядом при образовании соединений. Они обычно находятся в d-блоке периодической системы элементов и имеют относительно сложную ионную структуру.
К непереходным металлам относятся элементы, такие как железо, медь, цинк, никель, марганец и другие. Они обладают высокой проводимостью тепла и электричества, обычно обладают блестящим металлическим отливом и хорошей пластичностью.
Непереходные металлы широко используются в промышленности. Например, железо используется для производства стальных конструкций, а медь - для изготовления проводов и кабелей.
Особенностью непереходных металлов является возможность образования различных степеней окисления. Некоторые из них могут образовывать соединения с различными ионными зарядами, что делает их очень полезными в химической промышленности.
Кроме того, непереходные металлы могут образовывать комплексные соединения с другими элементами, что делает их незаменимыми в координационной химии.
Группа I: Алкалий

Алкалий - группа непереходных металлов, которые находятся в первой группе периодической таблицы. Группу I составляют литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Алкалии - самые реактивные металлы, которые хорошо взаимодействуют с водой и образуют щелочные растворы. Они обладают низкой плотностью и низкой температурой плавления. Из-за своей реактивности алкалии находятся в природе только в соединениях.
У алкалийных металлов есть одна электрон на внешнем энергетическом уровне, что делает их очень активными химическими элементами. Они легко отдают этот электрон и образуют положительные ионы. В соединениях алкалии имеют степень окисления +1.
- Литий (Li) - наименьший и наиболее легкий из алкалийных металлов. Используется в производстве литиевых батарей и лекарственных препаратов.
- Натрий (Na) - входит в состав обычной столовой соли и широко используется в пищевой промышленности.
- Калий (K) - важный элемент для растений, обеспечивающий их рост и развитие. Применяется в сельском хозяйстве в виде удобрений.
- Рубидий (Rb) - редкий элемент, используется в производстве оптических фильтров и в научных исследованиях.
- Цезий (Cs) - один из самых реактивных элементов, используется в электронике и в некоторых медицинских процедурах.
- Франций (Fr) - крайне редкий и нестабильный элемент, радиоактивен и используется только в научных исследованиях.
Алкалийные металлы имеют широкое применение в различных областях науки, технологии и промышленности. Их химические свойства и реактивность делают их важными компонентами в разработке новых материалов и технологий.
Группа II: Земно-алкалий

Вторая группа элементов периодической таблицы, также известная как группа II, включает в себя металлы, называемые земно-алкалиями. Эта группа состоит из следующих элементов: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Земно-алкалии получили свое название из-за того, что они имеют свойства как земельных металлов (снижение степеней окисления), так и алкалий (образование щелочных оксидов и гидроксидов). Они являются относительно реактивными металлами, которые могут реагировать с водой и взрываться при контакте с воздухом.
В группе II земно-алкалии имеют атомные номера от 4 до 12. Бериллий, химический элемент с атомным номером 4, является наименее реактивным элементом в этой группе, тогда как радий, химический элемент с атомным номером 88, является самым реактивным и радиоактивным.
Земно-алкалии имеют низкую плотность и низкий плавильный и кипятильный точки. Возможность образования катионов с двойным положительным зарядом (ионы +2) делает земно-алкалии важными для различных промышленных процессов и при производстве сплавов.
Земно-алкалии также играют важную роль в биологии. Например, кальций является необходимым элементом для строительства и поддержки костей и зубов у людей и других животных. Кроме того, магний является важным кофактором для множества ферментативных реакций в организмах.
Группа XIII: Бор

Бор является одним из элементов, входящих в группу XIII периодической системы химических элементов. Этот металл имеет атомный номер 5 и химический символ B. Бор в природе обычно представлен в виде минерала боракса или борита, а также встречается в элементарном состоянии в некоторых рудах и минералах.
Бор является необычным металлом, так как он обладает свойствами как металла, так и неметалла. Бор имеет очень высокую твердость и плавится при температуре около 2076 градусов Цельсия. Он прекрасно проводит электричество и тепло, что делает его полезным в различных применениях.
Бор является важным элементом во многих отраслях промышленности, включая производство стекла, керамики, пластмасс и лекарственных препаратов. Бор также используется в ядерной энергетике и в производстве электронной техники. Этот металл также имеет свойства, способствующие образованию борных соединений, которые активно применяются в сельском хозяйстве в качестве удобрений и пестицидов.
Группа XIV: Углерод
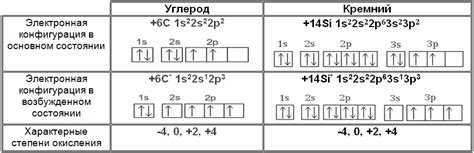
Углерод является химическим элементом, который находится в группе XIV периодической системы. Он имеет атомный номер 6 и общую химическую формулу C. Углерод - непереходный металл, который обладает уникальными химическими свойствами.
Углерод является основным строительным блоком живых организмов и имеет большое значение в биохимии. Он является основным компонентом органических соединений, таких как углеводы, липиды, белки и нуклеиновые кислоты. Углерод также является ключевым элементом природных полимеров, таких как резина, смолы и углеродные волокна.
Углерод имеет несколько аллотропных форм, самой известной из которых является алмаз. Другие аллотропные формы углерода включают графит, фуллерены и углеродные нанотрубки. Каждая из этих форм имеет свои особенности и применения в различных областях науки и технологии.
- Алмаз - кристаллическая форма углерода, которая обладает твердостью и является одним из самых ценных драгоценных камней.
- Графит - мягкий и проводящий электричество материал, который используется в качестве пишущего инструмента и в производстве лубрикантов.
- Фуллерены - молекулы углерода, которые образуют шарообразные структуры и могут использоваться в медицине, электронике и катализе.
- Углеродные нанотрубки - цилиндрические структуры, состоящие из атомов углерода, которые обладают уникальными механическими и электрическими свойствами.
Углерод также играет важную роль в геологических процессах и формировании полезных ископаемых, таких как нефть и уголь. Таким образом, группа XIV, которую представляет углерод, играет критическую роль в нашей жизни и имеет широкий спектр приложений в различных отраслях науки и технологии.
Группа XV: Азот
Азот является не переходным металлом и входит в группу XV таблицы Менделеева. Находится в пятой периоде периодической системы элементов и обозначается символом N.
Азот является химическим элементом с атомным номером 7. Он обладает свойствами непереходного металла, то есть не обладает достаточным числом электронов, чтобы проявить свойства переходного металла. У азота 2 электрона в внутреннем слое и 5 электронов во внешнем, что делает его нестабильным и реактивным.
Азот встречается в природе в виде двухизотопного газа, состоящего почти полностью из двух атомов N2, которые связаны между собой тройными связями. Это делает газ неподвижным и весьма инертным. Азот является одним из основных компонентов земной атмосферы, его концентрация составляет около 78%.
Азот широко используется в промышленности в процессах азотной химии. Например, азот используется для производства азотной кислоты, аммиака и других важных химических соединений. Также азот используется в качестве реагента при получении различных органических соединений.
Группа XVI: Кислород

Кислород (O) - элемент химической группы XVI, который является газообразным в обычных условиях. Он является одним из самых распространенных элементов в земной коре и составляет около 21% объема атмосферы Земли.
Кислород играет важную роль в жизни многих организмов, так как служит для дыхания и окисления различных веществ. Он также используется в промышленности для производства различных веществ, таких как стекло, металлы и пластмассы.
Кислород является очень реактивным элементом и может образовывать соединения с практически всеми другими элементами. Он образует оксиды, кислородные кислоты и многочисленные органические соединения.
Одним из наиболее известных соединений кислорода является вода (H2O), которая состоит из двух атомов водорода и одного атома кислорода. Вода является жизненно важным веществом для всех организмов и играет ключевую роль в многих химических реакциях, происходящих в природе.
Вопрос-ответ

Какие металлы относятся к категории непереходных?
К категории непереходных металлов относятся железо (Fe), цинк (Zn), медь (Cu), свинец (Pb), никель (Ni), алюминий (Al) и титан (Ti).
Какие свойства характеризуют непереходные металлы?
Непереходные металлы обладают высокой плотностью, тугоплавкостью и жаропрочностью. Они не обладают высокой проводимостью тепла и электричества, в отличие от переходных металлов.
Какие примеры использования непереходных металлов?
Непереходные металлы используются в различных отраслях промышленности. Например, железо применяется в производстве стали, алюминий используется для изготовления легких и прочных конструкций, медь используется в электротехнике и электронике.
Какова роль непереходных металлов в живых организмах?
Непереходные металлы играют важную роль в живых организмах. Например, железо выполняет функцию переноса кислорода в крови, цинк участвует в работе ферментов, медь необходима для образования гемоглобина.
