Оксиды - это неорганические химические соединения, состоящие из металлических и неметаллических элементов. Они играют важную роль в химических реакциях и имеют широкий спектр применений в различных отраслях промышленности и науки.
Металлы, образующие кислотные оксиды, характеризуются тем, что они реагируют с водой, образуя кислоты. Кислотные оксиды имеют кислотные свойства и способны отдавать протоны. Они могут быть получены путем окисления металла или окисления соли металла в соответствии с определенными условиями.
Примерами металлов, образующих кислотные оксиды, являются алюминий (Al), железо (Fe), цинк (Zn) и свинец (Pb). Оксид алюминия (Al2O3) обладает кислотными свойствами и называется алюминиевой кислотой. Кислотный оксид железа (Fe2O3) известен как оксид железа (III) или ржавчина. Оксид цинка (ZnO) и оксид свинца (PbO) также являются кислотными оксидами и обладают определенными химическими и физическими свойствами.
Металлы, образующие кислотные оксиды, играют важную роль в химической промышленности, материаловедении и других областях науки. Изучение и использование этих соединений не только помогает понять их химические свойства и реактивность, но и позволяет разрабатывать новые материалы и технологии с применением этих металлов.
Реакция металлов с кислородом

Металлы, образующие кислотные оксиды, обладают способностью взаимодействовать с кислородом и образовывать оксиды.
Процесс взаимодействия металлов с кислородом называется окислительной реакцией. В ходе этой реакции металл отдает электроны кислороду, при этом происходит окисление металла и редукция кислорода.
Примеры металлов, образующих кислотные оксиды,:
- Алюминий (Al): при взаимодействии с кислородом образует оксид алюминия (Al2O3).
- Магний (Mg): реагирует с кислородом, образуя оксид магния (MgO).
- Железо (Fe): при окислении с кислородом образуется оксид железа (Fe2O3).
Реакция металлов с кислородом важна с практической точки зрения. Например, оксид алюминия (Al2O3) используется в производстве алюминиевой фольги и упаковочных материалов. Оксид магния (MgO) применяется для производства огнеупорных материалов. Оксид железа (Fe2O3) широко используется в производстве красок и пигментов.
Таблица "Металлы, образующие кислотные оксиды":
| Металл | Оксид |
|---|---|
| Алюминий (Al) | Al2O3 |
| Магний (Mg) | MgO |
| Железо (Fe) | Fe2O3 |
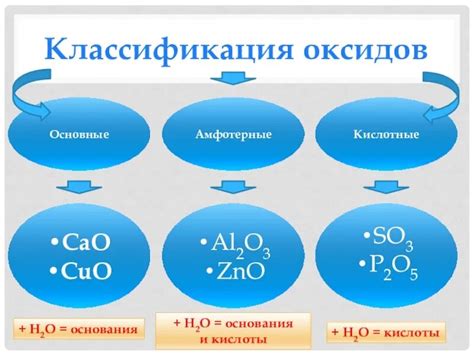
Свойства кислотных оксидов
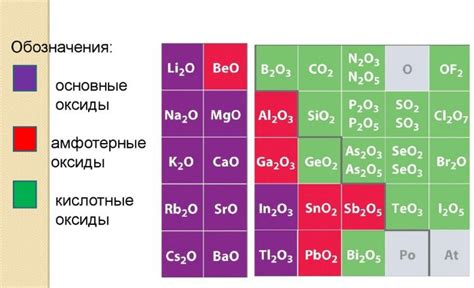
Кислотные оксиды, также известные как ангидриды, представляют собой оксиды, которые образуют кислоты при взаимодействии с водой. У них есть несколько характеристик и свойств, которые определяют их реактивность и использование:
- Кислотность: Кислотные оксиды реагируют с водой, образуя кислоты. Они могут быть использованы для создания различных кислот, таких как серная кислота (H2SO4) из серного оксида (SO3).
- Реактивность: Кислотные оксиды обычно являются сильными окислителями и могут поддерживать горение. Они часто используются в промышленности для процессов окисления или взрывчатых смесей.
- Свойства кислоты: Поскольку кислотные оксиды образуют кислоты, они могут иметь кислотные свойства. Они могут реагировать с основаниями, образуя соли и воду.
- Токсичность: Некоторые кислотные оксиды могут быть ядовитыми и опасными для здоровья. Это, в основном, связано с их реактивностью и способностью агрессивно взаимодействовать с тканями организма.
- Коррозионные свойства: Кислотные оксиды могут быть коррозивными и вызывать разрушение материалов, особенно металлов. Такие оксиды, как оксиды серы или азота, могут вызывать коррозию металлов при взаимодействии с влажностью или воздухом.
Основные представители

Среди металлов, образующих кислотные оксиды, можно выделить несколько основных представителей.
- Алюминий (Al)
- Цинк (Zn)
- Магний (Mg)
- Железо (Fe)
- Медь (Cu)
- Свинец (Pb)
- Никель (Ni)
- Кобальт (Co)
Каждый из этих металлов способен образовывать оксиды, которые при растворении в воде образуют кислотные растворы.
Например, оксид алюминия (Al2O3) образует кислотный раствор алюминия (Al3+). А оксид цинка (ZnO) дает кислотный раствор цинка (Zn2+).
Важно отметить, что не все металлы образуют кислотные оксиды. Некоторые металлы образуют щелочные или амфотерные оксиды, которые при растворении в воде образуют щелочные или нейтральные растворы. К примеру, оксид кальция (CaO) образует щелочный раствор кальция (Ca2+), а оксид церия (CeO2) - амфотерный раствор церия (Ce4+).
Применение кислотных оксидов

Кислотные оксиды играют важную роль во многих сферах нашей жизни. Они широко применяются в различных отраслях промышленности и научных исследованиях.
В первую очередь, кислотные оксиды используются в производстве различных типов кислот, таких как серная, азотная, хлорная и другие. Они являются основными предшественниками для производства этих кислот и служат для увеличения их концентрации.
Кроме того, кислотные оксиды применяются в процессе производства удобрений. Они являются ключевыми компонентами в составе многих удобрений, таких как азотные и фосфорные удобрения. Они способствуют повышению плодородности почвы и увеличению урожайности сельскохозяйственных культур.
Кислотные оксиды также находят широкое применение в химической промышленности. Они используются при производстве пластиков, резин, красителей, лаков и других химических соединений. Они являются важными компонентами для получения требуемых свойств и качественных характеристик этих продуктов.
Кроме того, кислотные оксиды играют роль в электронике и электрике. Они применяются для создания электрических контактов, при производстве полупроводниковых материалов и электронных компонентов. Они обладают высокой электропроводностью и другими полезными свойствами, что делает их неотъемлемыми в этих областях.
Безопасное использование кислотных оксидов
Безопасное использование кислотных оксидов требует соблюдения определенных мер предосторожности и правил, чтобы предотвратить возможные риски и потенциальные вредные последствия.
Прежде всего, необходимо использовать соответствующие средства индивидуальной защиты, такие как защитные очки, перчатки и халаты, чтобы предотвратить контакт с кислотными оксидами на коже, глазах и одежде.
Также важно обеспечить хорошую вентиляцию рабочего места, чтобы избежать сосредоточения вредных испарений в воздухе. При работе с кислотными оксидами необходимо держаться подальше от открытого огня и источников тепла, так как они могут вызвать возгорание или взрыв.
При хранении и транспортировке кислотных оксидов необходимо соблюдать специальные правила, чтобы избежать аварий и проливов. Кислотные оксиды должны храниться в специально оборудованных хранилищах или таре, которая должна быть надежно закрыта и защищена от проникновения влаги и других вредных веществ.
Важно иметь под рукой информацию о свойствах и конкретных мерах предосторожности для каждого конкретного кислотного оксида. Эта информация должна быть доступна на рабочем месте и регулярно обновляться.
Обучение и соблюдение всех этих правил и мер предосторожности помогут минимизировать риски и обеспечить безопасное использование кислотных оксидов.
Вопрос-ответ

Какие металлы образуют кислотные оксиды?
Некоторые металлы, такие как сера, фосфор, азот, образуют кислотные оксиды.
Каковы примеры металлов, образующих кислотные оксиды?
Примеры металлов, образующих кислотные оксиды, включают галлий, алюминий, цинк, железо и медь.
