Электроотрицательность - это фундаментальная характеристика элементов, которая показывает их способность притягивать электроны в химических соединениях. Все элементы имеют свою электроотрицательность, и она может варьироваться в широком диапазоне от 0,7 до 4,0 по шкале Полинга.
Металлы и неметаллы имеют разные уровни электроотрицательности. Неметаллы, обычно, имеют более высокую электроотрицательность, чем металлы. Это связано с их стремлением притягивать электроны сильнее, чем металлы. Таким образом, неметаллы обычно обладают сильной способностью образовывать ковалентные связи и притягивать электроны к себе в химических соединениях.
Металлы, с другой стороны, имеют более низкую электроотрицательность. Это связано с их способностью отдавать электроны при образовании ионов положительного заряда. Металлы обычно образуют ионные связи и служат источником электронов для неметаллов. Они часто выступают в роли окислителей в реакциях окисления-восстановления.
В целом, можно сказать, что неметаллы более электроотрицательные, чем металлы, и это связано с их химическими свойствами и способностью притягивать электроны. Однако, стоит отметить, что электроотрицательность каждого элемента варьирует в зависимости от контекста и комплексности соединения.
Отличия металлов и неметаллов

Металлы и неметаллы - это две основные категории химических элементов, которые отличаются своими физическими и химическими свойствами.
Металлы обладают следующими характеристиками:
- Высокая электропроводность. Металлы являются хорошими проводниками электричества и тепла.
- Металлический блеск. Металлы имеют характерный блеск на поверхности, вызванный отражением света.
- Пластичность и формоизменяемость. Металлы обладают способностью легко изменять свою форму и поддаваться деформации.
- Высокая плотность. Металлы обычно обладают высокой плотностью и тяжестью.
- Свойство образовывать ионы. Металлы могут образовывать положительно заряженные ионы, которые вступают в химические реакции с отрицательно заряженными ионами неметаллов.
Неметаллы, в свою очередь, проявляют следующие свойства:
- Плохая электропроводность. Неметаллы обычно являются плохими проводниками электричества и тепла.
- Отсутствие блеска. Неметаллы не имеют металлического блеска на поверхности и обычно выглядят матовыми или прозрачными.
- Хрупкость или нетвердость. Неметаллы обычно обладают хрупкой структурой и слабой механической прочностью.
- Низкая плотность. Неметаллы, как правило, имеют низкую плотность и невысокую массу.
- Свойство образовывать отрицательные ионы. Неметаллы могут образовывать отрицательно заряженные ионы, которые вступают в химические реакции с положительно заряженными ионами металлов.
Эти отличия между металлами и неметаллами определяют их различное поведение в химических реакциях и их применение в различных областях науки и промышленности.
Металлы: основные характеристики

Металлы – это группа химических элементов, которые обладают особыми свойствами и характеристиками. Они являются одним из двух основных типов химических элементов, вторым типом являются неметаллы.
Основные характеристики металлов включают:
- Электроотрицательность: металлы имеют низкую электроотрицательность, что означает, что они обладают способностью отдавать электроны в процессе химических реакций. Это одна из основных причин, почему металлы обычно являются хорошими проводниками электричества и тепла.
- Металлический блеск: металлы имеют способность отражать свет и обладают блестящей поверхностью. Это свойство объясняется наличием свободных электронов, которые могут свободно двигаться внутри кристаллической решетки металла и отражать световые волны.
- Пластичность и расплавляемость: металлы могут быть легко подвергнуты деформации и изменению формы без разрушения. Они обладают высокими точками плавления и кипения, что делает их радиоактивными для использования в различных процессах и промышленности.
- Прочность и твердость: металлы обычно обладают высокой прочностью и твердостью, что делает их идеальными материалами для конструкции и производства различных изделий. Они могут быть легко формованы в различные предметы и устойчивы к различным воздействиям.
- Металлическая связь: в металлах электроны образуют специфическую связь, называемую металлической связью. Это особенность, которая позволяет металлам обладать такими уникальными свойствами, как электропроводность, теплопроводность и пластичность.
Важно отметить, что каждый металл имеет свои собственные уникальные свойства и характеристики, и их комбинация обуславливает разнообразие и широкое применение металлов в различных областях нашей жизни.
Неметаллы: основные характеристики

Неметаллы являются одной из двух основных категорий химических элементов, в отличие от металлов. Они обладают рядом уникальных характеристик, которые отличают их от металлов и делают их ценными в различных областях жизни и науки.
Электроотрицательность: Неметаллы обладают более высокой электроотрицательностью по сравнению с металлами. Это означает, что они имеют большую способность притягивать электроны во внешних электронных оболочках атома. Благодаря этому они способны формировать стабильные химические связи с другими элементами и молекулами, что оказывает влияние на их физические и химические свойства.
Фрагильность: Большинство неметаллов обладает хрупкой структурой, что означает, что они легко ломаются или растрескиваются при воздействии внешних сил. Это связано с тем, что атомы неметаллов образуют ковалентные связи, которые обеспечивают очень слабое соединение между ними. Поэтому неметаллы обычно находятся в газообразном или твердом состоянии при комнатной температуре и давлении.
Реактивность: Неметаллы обладают высокой реактивностью, особенно в связи с другими элементами. Они часто образуют соединения с металлами, создавая соли или оксиды, и могут вступать в химические реакции с веществами под воздействием тепла, света или электричества. Некоторые неметаллы, такие как хлор, являются сильными окислителями, способными отдавать электроны и реагировать с другими веществами.
Пространственная структура: Неметаллы имеют сложные пространственные структуры, обычно образующие молекулы, состоящие из двух или более атомов. Это позволяет им образовывать разнообразные химические соединения и молекулы с уникальными свойствами и функциями.
Электроотрицательность: что это такое?

Электроотрицательность – это характеристика атомов элементов, отражающая их способность привлекать к себе общие электроны в химической связи.
Электроотрицательность является физической величиной, которая измеряется по шкале, разработанной Линусом Полингом. Она принимает значения от 0 до 4, где 0 – минимальное значение электроотрицательности (неполярные связи), а 4 – максимальное значение (максимальная электроотрицательность элемента).
Наиболее электроотрицательными элементами являются неметаллы, такие как флуор, кислород, клор, бром и их соединения. Эти элементы обладают большими значениями электроотрицательности и, следовательно, сильно притягивают общие электроны в химической связи.
Металлы, в свою очередь, обладают меньшей электроотрицательностью, что делает их менее способными привлекать электроны в химической связи. Они, как правило, образуют ионные или металлические связи с другими элементами.
Значение электроотрицательности элементов играет важную роль в понимании химических связей и реакций. Знание электроотрицательности позволяет предсказывать свойства и поведение химических соединений.
Сравнение электроотрицательности металлов и неметаллов

Электроотрицательность - это способность атома притягивать к себе электроны в химической связи. Чем выше значение электроотрицательности, тем сильнее атом притягивает электроны и тем больше его отрицательный заряд.
Металлы обычно обладают низкой электроотрицательностью. Это связано с их основными физическими и химическими характеристиками. Металлы образуют ионные или металлические связи, где электроны легко передаются между атомами. Они обычно образуют положительно заряженные ионы, называемые катионами.
Неметаллы, напротив, имеют высокую электроотрицательность. Они имеют тенденцию притягивать электроны и образовывать отрицательно заряженные ионы, называемые анионами. Неметаллические связи обычно являются ковалентными, где электроны совместно используются атомами.
Сравнение электроотрицательности между металлами и неметаллами дает нам понимание их химического поведения. Металлы имеют тенденцию отдавать электроны неметаллам, что позволяет образовывать ионные соединения. Неметаллы, в свою очередь, притягивают электроны к себе и могут образовывать ковалентные связи.
Значение электроотрицательности также влияет на различные свойства элементов, такие как температура плавления и кипения, электропроводность и реакционная способность. Металлы, с их низкой электроотрицательностью, имеют высокую температуру плавления и кипения, а также хорошую электропроводность. Неметаллы, с их высокой электроотрицательностью, обычно имеют низкую температуру плавления и кипения, и плохо проводят электричество.
Влияние электроотрицательности на химические свойства

Электроотрицательность является важной характеристикой химических элементов, которая определяет их способность притягивать электроны в химических связях. Металлы и неметаллы имеют разное значение электроотрицательности, что влияет на их химические свойства.
Неметаллы, обладающие более высокой электроотрицательностью, имеют большую способность притягивать электроны и образовывать ковалентные связи. Они обычно образуют отрицательно заряженные ионы или совместные электроны в химических реакциях. Примерами таких неметаллов являются кислород, хлор, фтор и азот.
Металлы, наоборот, имеют более низкую электроотрицательность, что означает, что они имеют меньшую способность притягивать электроны. Это позволяет им образовывать ионы положительной заряды и создавать металлические связи. Металлы обычно характеризуются хорошей электропроводностью и металлическим блеском.
Различие в электроотрицательности между металлами и неметаллами определяет их взаимодействие в химических реакциях. Металлы и неметаллы обычно образуют ионные или ковалентные соединения в зависимости от разности их электроотрицательности. Это разнообразие связей позволяет образовывать различные химические соединения с различными свойствами и применениями.
Примеры элементов с высокой электроотрицательностью
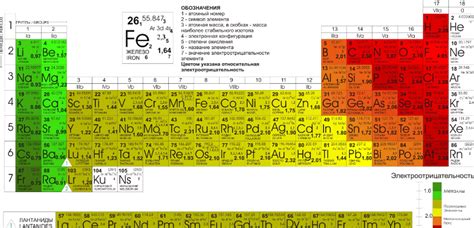
Электроотрицательность - это способность атома притягивать электроны к себе во время образования химической связи. Чем выше электроотрицательность элемента, тем сильнее он притягивает электроны и тем более ионизирующая или отрицательная его связь.
Неметаллы обычно имеют более высокую электроотрицательность по сравнению с металлами. Некоторые из самых электроотрицательных элементов включают флуор, кислород, хлор, азот и бром.
Флюор (F) - самый электроотрицательный элемент в периодической системе элементов. Он используется во многих промышленных процессах и имеет широкое применение в производстве различных материалов и химических соединений.
Кислород (O) - очень электроотрицательный элемент, который играет важную роль в биологических процессах и в составе многих соединений. Он является одним из основных составляющих воздуха и необходим для жизни всех организмов.
Хлор (Cl) - еще один элемент с высокой электроотрицательностью. Он широко используется в химической промышленности, в производстве пластика, соляной кислоты и других продуктов.
Азот (N) - также имеет высокую электроотрицательность и широко присутствует в атмосфере. Он играет важную роль в растительном и животном мире, а также используется в производстве удобрений.
Бром (Br) - элемент, имеющий достаточно высокую электроотрицательность, а также является одним из единственных жидких неметаллов. Бром широко используется в производстве огнезащитных, противомикробных и других химических соединений.
В общем, неметаллы имеют более высокую электроотрицательность, чем металлы, и они играют важную роль во многих химических процессах и реакциях.
Вопрос-ответ

Какие элементы считаются электроотрицательными?
Электроотрицательность - это способность атома притягивать к себе электроны в химической связи. Электроотрицательные элементы - это те, которые имеют большую способность притягивать электроны. Из них наиболее электроотрицательными считаются неметаллы, такие как фтор, хлор, кислород и азот.
Почему неметаллы являются наиболее электроотрицательными элементами?
Неметаллы обладают большим количеством электронов во внешней электронной оболочке, что позволяет им сильнее притягивать электроны к себе. Также неметаллы имеют высокую энергию ионизации и электроотрицательность, что делает их наиболее электроотрицательными элементами.
Металлы также могут быть электроотрицательными?
Да, некоторые металлы также обладают электроотрицательностью. Однако, обычно она ниже, чем у неметаллов. Некоторые металлы, такие как алюминий и свинец, могут проявлять некоторую электроотрицательность, но в целом металлы считаются менее электроотрицательными, чем неметаллы.
Влияет ли электроотрицательность элементов на их химические свойства?
Да, электроотрицательность элементов играет важную роль в их химических свойствах. Более электроотрицательные элементы обладают большей стремлением к образованию химических связей и могут вступать в реакции с менее электроотрицательными элементами. Это свойство определяет многие химические реакции и свойства соединений.
Как электроотрицательность влияет на силу химической связи?
Более электроотрицательные элементы имеют большую способность притягивать электроны, что приводит к образованию более сильных химических связей. В результате, соединения, в которых участвуют более электроотрицательные элементы, обычно имеют более высокую энергию связи и более тугоплавкие и твердые структуры.
