Металлы представляют собой материалы, которые обычно очень устойчивы к разрушению. Однако существуют кислотные жидкости, которые могут привести даже самые прочные металлы к разрушению. Это вызвано их способностью взаимодействовать с металлической структурой и вызывать химическую реакцию, которая разрушает материал.
Среди кислот, которые способны быстро разъедать металл, наиболее известными являются соляная (HCl) и серная (H2SO4) кислоты. Обе эти кислоты в сильно разбавленном виде используются в промышленности для очистки и гальванического покрытия металлических изделий. Однако, если эти кислоты использовать в концентрированной форме или несоблюдать меры предосторожности, они могут нанести непоправимый вред металлическим изделиям.
Действие кислот на металл связано с их способностью отбирать электроны у металлических атомов. При этом образуется катион металла и водородный ион (H+), который вступает в реакцию с водой и расщепляется на протоны (H+) и гидроксидные ионы (OH-). Катион металла в серной кислоте может вступить в реакцию с активными ионами серной кислоты, образуя соли.
Кислотная жидкость: опасность для металлов

Кислотные жидкости представляют серьезную опасность для металлических поверхностей. Их химические свойства могут вызывать разрушение и окисление металлов, что приводит к потере прочности и ухудшению их внешнего вида.
Сильные кислоты, такие как серная, соляная и азотная, обладают высокой реактивностью и агрессивностью при контакте с металлами. Они способны быстро растворять металлические ионы, образуя соединения, которые снижают прочность материала и могут привести к его разрушению.
Действие кислот на металлы основано на процессе окисления. Кислоты обладают высоким потенциалом окисления, и поэтому они могут передавать электроны от металла к себе. Это приводит к коррозии и образованию окиси металла на поверхности, что приводит к разрушительным эффектам.
Примеры реакций между кислотами и металлами:
- Соляная кислота (HCl) реагирует с железом (Fe), образуя хлорид железа (FeCl2) и выделяя молекулы водорода (H2).
- Серная кислота (H2SO4) реагирует с алюминием (Al), образуя сульфат алюминия (Al2(SO4)3) и выделяя молекулы водорода (H2).
Чтобы предотвратить разрушение металлических поверхностей кислотами, необходимо принимать соответствующие меры. Во-первых, следует избегать контакта металлов с кислотными жидкостями или осуществлять его в контролируемых условиях. Во-вторых, для защиты металлов от коррозии можно использовать различные защитные покрытия, такие как краски, эмали или специальные покрытия, которые обеспечивают барьер для кислоты и уменьшают риск ее воздействия на металлы.
В заключение, кислотные жидкости представляют серьезную опасность для металлических поверхностей. Их агрессивность может вызвать разрушение и окисление металлов, что требует принятия соответствующих мер предосторожности, чтобы предотвратить коррозию и сохранить прочность металлических конструкций.
Реакция железа и соляной кислоты

Реакция между железом и соляной кислотой является одной из самых известных и широко распространенных реакций между металлом и кислотой. В результате этой реакции образуется солевой комплекс и выделяется водородный газ.
Соляная кислота (хлороводородная кислота) имеет формулу НСl и является одной из наиболее распространенных кислот. Она обладает сильными кислотными свойствами и хорошо реагирует с металлами, в том числе с железом.
Реакция происходит следующим образом: вначале идет активация соляной кислоты с образованием хлоридного иона (Cl-) и протона (H+). Далее протон образует связь с поверхностью металла, образуя гидроксидное ионное соединение. Сам металл превращается в водородный катион (H+) и выделяется в виде газа.
Реакция между железом и соляной кислотой происходит достаточно быстро, особенно при повышенных температурах или при использовании концентрированной кислоты. В результате реакции образуется раствор солята железа (FeCl2 или FeCl3) и выделяется водородный газ.
Реакция железа и соляной кислоты находит широкое применение в промышленности и лабораторной практике. Например, она используется для очистки металлических поверхностей от ржавчины, а также для получения солей железа, которые имеют различные применения в различных отраслях производства.
Этапы взаимодействия металла и азотной кислоты
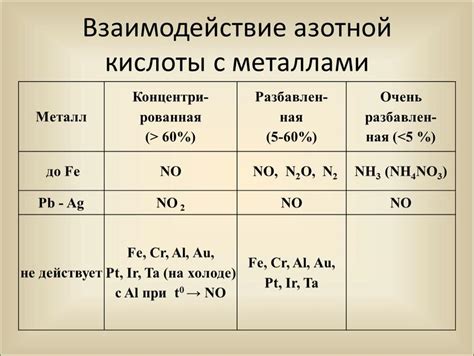
Взаимодействие между металлом и азотной кислотой происходит по определенным этапам, которые приводят к быстрому разрушению металла.
Первый этап – окисление металла. Азотная кислота содержит оксидирующие свойства, поэтому она способна окислить поверхность металла. На этом этапе образуются оксиды или нитриты металла, которые могут быть не очень стойкими и легко разрушаться при следующих этапах.
Второй этап – коррозия. В результате окисления металла происходит образование коррозионного слоя на его поверхности. Этот слой является хрупким и неустойчивым, что приводит к возможному разрушению металла.
Третий этап – дальнейшее разрушение металла. После образования коррозионного слоя на поверхности металла начинают происходить физические и химические процессы, которые дополнительно разрушают металл и приводят к его деградации.
Таким образом, взаимодействие металла и азотной кислоты происходит через несколько этапов, каждый из которых приводит к ускоренному разрушению металлической поверхности. Это важно учитывать при работе с азотной кислотой и металлами, чтобы предотвратить возможные негативные последствия.
Химическое воздействие соляной кислоты на алюминий

Соляная кислота (HCl) является одной из наиболее известных и широко используемых кислотных веществ в химии. Ее химическое воздействие на алюминий может быть вызвано несколькими факторами, включая его высокую реакционную способность и кислотность.
Взаимодействие соляной кислоты с алюминием приводит к образованию водорода и хлорида алюминия. Кислота действует на поверхностный слой оксида алюминия, который препятствует дальнейшей реакции. При реакции алюминий растворяется в кислоте, образуя раствор, который включает ионы алюминия и хлоридные ионы.
Соляная кислота обычно распознается своим едким запахом и способностью разъедать многие металлы. Алюминий считается относительно реактивным металлом, поэтому он хорошо реагирует с кислотами, включая соляную кислоту. Реакция между алюминием и соляной кислотой происходит с выделением газа, что является одним из признаков происходящей реакции.
Следует отметить, что химическое воздействие соляной кислоты на алюминий может привести к образованию пассивной оксидной пленки на поверхности металла. Эта пленка может замедлить или остановить процесс разрушения металла под воздействием кислоты. Однако с длительным воздействием или концентрированной соляной кислотой оксидная пленка может быть разрушена, что приводит к дальнейшему разрушению алюминия.
Таким образом, химическое воздействие соляной кислоты на алюминий можно описать как реакцию между кислотой и оксидной пленкой, формирующейся на поверхности металла. Реакция приводит к образованию раствора, содержащего ионы алюминия и хлоридные ионы. Это делает соляную кислоту одной из кислотных жидкостей, разъедающих алюминий быстро и эффективно.
Как хром реагирует с сульфатной кислотой

Хром – это химический элемент с атомным номером 24 в таблице элементов Менделеева. Он является твёрдым металлом серебристо-серого цвета и обладает высокой коррозионной стойкостью, однако реагирует с некоторыми кислотами, включая сульфатную кислоту.
Сульфатная кислота (H2SO4) – это одна из наиболее распространенных и сильных кислот, которая обладает агрессивными свойствами и высокой реакционной способностью. При контакте с хромом она вызывает реакцию, которая приводит к разрушению металла.
При взаимодействии хрома с сульфатной кислотой происходит окислительно-восстановительная реакция. Хром окисляется до ионов Cr3+, а сульфатная кислота восстанавливается до сульфата водорода и сульфита:
- 2Cr + 3H2SO4 → Cr2(SO4)3 + 3H2O + SO2
Реакция сульфатной кислоты с хромом протекает с выделением большого количества тепла и газов. Газы, образующиеся в ходе реакции, могут быть токсичными, что делает данную реакцию опасной.
Одна из особенностей взаимодействия хрома с сульфатной кислотой заключается в образовании гидрооксосульфата хрома(III) – зеленого осадка. Этот осадок, известный также как хромовая зелень, имеет широкое применение в химической и кожевенной промышленности.
Таким образом, реакция хрома с сульфатной кислотой является нетипичной и может привести к разрушению металла и образованию отдельных химических соединений.
Домашний эксперимент: разрушение цинковой пластины с уксусной кислотой

Для проведения простого домашнего эксперимента по разрушению металла можно воспользоваться уксусной кислотой и цинковой пластиной. Цинк является металлом, который реагирует с уксусной кислотой, образуя растворимую соль и выделяя газ.
Для начала эксперимента необходимо приготовить 9%-ный раствор уксусной кислоты. Далее возьмите цинковую пластину и поместите ее в стакан с кислотой. Кислота начнет медленно разъедать защитную пленку на поверхности металла и взаимодействовать с цинком.
В процессе взаимодействия между кислотой и цинком образуется газ, который можно наблюдать в виде пузырьков. Это газ – это водород, который выделяется в результате разложения уксусной кислоты и цинка. Благодаря металлической структуре и агрессивности уксусной кислоты, происходит постепенное разъедание цинковой пластины.
Этот простой и безопасный эксперимент позволяет наглядно продемонстрировать процесс взаимодействия металла с кислотой и его последствия. Результатом эксперимента будет полностью разрушенная цинковая пластина и образовавшийся газ в виде пузырьков в стакане с кислотой.
Агрессия фтороводорода на сталь

Фтороводород (HF) - кислотное соединение, которое обладает высокими агрессивными свойствами по отношению к многим материалам, включая сталь. Контакт с HF может вызвать серьезные повреждения металла и привести к его разрушению.
Фтороводород взаимодействует со сталью в результате химической реакции, называемой коррозией. При контакте с HF, на поверхности стали образуется слой коррозии, который продолжает разрушаться под воздействием кислоты.
HF разъедает сталь путем образования фторидов металла. Фториды металла обладают высокой растворимостью в HF, поэтому они легко вымываются из поверхности металла, что увеличивает его разрушение. Опасность заключается в том, что коррозия происходит на микроскопическом уровне, поэтому внешние признаки разрушения металла могут быть незаметны.
Фтороводород также обладает высокой плотностью пара, что усиливает его агрессивность по отношению к металлам. Взаимодействие HF с металлами, такими как сталь, приводит к образованию водорода, который накапливается внутри металла и вызывает внутреннее напряжение, что приводит к трещинам и разрушению металла.
Поэтому крайне важно следить за безопасностью при использовании HF и применять соответствующие средства защиты при работе с этой кислотной жидкостью.
Какой выбрать материал, устойчивый к агрессивным кислотам?

При работе с агрессивными кислотами важно выбрать подходящий материал, чтобы избежать разрушения или коррозии. Оптимальный выбор может зависеть от конкретного раствора и условий эксплуатации. Вот несколько материалов, которые обычно проявляют высокую степень устойчивости к кислотам и могут быть использованы в таких условиях:
- Нержавеющая сталь: этот материал часто используется в химической промышленности благодаря высокой стойкости к кислотам. Она продолжает свою работу даже в сильно агрессивных средах, таких как соляная или серная кислота.
- Полипропилен: это легкий пластиковый материал, который является химически инертным к большинству кислот. Он может использоваться в агрессивных средах, таких как азотная, азотная или серная кислота.
- Тефлон: также известный как политетрафторэтилен, тефлон является высокоустойчивым материалом к кислотам. Он обладает низким коэффициентом трения, непроницаемостью и химической инертностью.
- Стекло: химическая стойкость стекла делает его прекрасным выбором для работы с агрессивными кислотами. Для различных кислот могут быть требованы разные типы стекла, например, кварцевое стекло широко используется в лабораториях.
Однако стоит отметить, что выбор материала должен быть основан на конкретной кислоте и условиях эксплуатации. Кроме того, следует учитывать такие факторы, как температура, концентрация кислоты и время воздействия. Поэтому перед выбором материала крайне важно провести тщательное исследование и проконсультироваться с профессионалами в области химического оборудования и материалов.
Вопрос-ответ

Какая кислотная жидкость разъедает металл быстро?
Существует несколько кислотных жидкостей, которые могут быстро разъедать металл. Одной из них является азотная кислота (HNO3), которая обладает сильными окислительными свойствами и взаимодействует с металлами, вызывая их разложение. Еще одним примером может быть хлорная кислота (HCl), которая также является сильным окислителем и способна разъедать металлы быстро. Однако, следует помнить, что работа с такими кислотами требует предосторожности и специальных условий.
Какие кислоты взаимодействуют с металлами и разъедают их?
С металлами могут взаимодействовать несколько кислот и вызывать их разъедение. Некоторые из таких кислот включают азотную кислоту (HNO3), которая обладает сильными окислительными свойствами и может разлагать металлы. Также, хлорная кислота (HCl) может вызывать разрушение металлов при взаимодействии с ними. Фтористоводородная кислота (HF) также способна разъедать металлы. Однако, следует отметить, что работа с такими кислотами требует особых условий и должна проводиться с осторожностью.
Какая кислота может разлагать металлы быстро?
Азотная кислота (HNO3) является одной из кислот, которая может быстро разлагать металлы. Она обладает сильными окислительными свойствами и может вызывать разложение металлов при взаимодействии с ними. Однако, следует помнить, что работа с азотной кислотой требует специальных условий и осторожности.
Какие кислоты могут разъедать металлы быстро и эффективно?
Несколько кислотных жидкостей могут эффективно и быстро разъедать металлы. Одной из таких кислот является азотная кислота (HNO3), которая обладает сильными окислительными свойствами и может разлагать металлы, вызывая их разрушение. Еще одним примером может быть хлорная кислота (HCl), которая также обладает окислительными свойствами и способна разъедать металлы. Другими эффективными кислотами могут быть серная кислота (H2SO4) и фтористоводородная кислота (HF).
