Химическая связь между металлами - это особый вид взаимодействия атомов металлов, который обусловлен их особыми физическими и химическими свойствами. В отличие от связей, образующихся между неметаллами, химическая связь между металлами характеризуется высокой проводимостью электричества и тепла, а также способностью образовывать кристаллическую структуру.
Основными особенностями химической связи металлов являются металлический блеск, высокая пластичность и ионизация. Металлы обладают свободными электронами в своей внешней электронной оболочке, что обуславливает их способность к проводимости электричества и тепла. Структура металлов формируется благодаря кристаллической решетке, в которой атомы металла окружены множеством свободных электронов.
Механизм образования химической связи металлов основан на взаимодействии электронов в свободной электронной оболочке атомов металла. Под действием электрических сил электроны образуют облако, которое облегчает перемещение свободных электронов между атомами металла. Это облегчает распространение электрического тока и тепла.
Химическая связь металлов: особенности и механизм образования

Металлы – это химические элементы, обладающие особыми свойствами, такими как высокая теплопроводность, электропроводность и гибкость. Одним из ключевых свойств металлов является наличие металлической связи.
Металлическая связь образуется между атомами металла и представляет собой силовую связь, основанную на обмене электронами. При этом, в отличие от ионной и ковалентной связи, между атомами металла нет твердых границ и они могут свободно перемещаться.
Механизм образования металлической связи основан на наличии свободных электронов в внешних энергетических оболочках атомов металла. Эти свободные электроны образуют электронное облако, в котором атомы металла испытывают силы притяжения.
Металлическая связь имеет несколько особенностей. Во-первых, она обеспечивает металлам хорошую пластичность, благодаря перемещению атомов в электронном облаке. Это позволяет металлам быть ковкими и легко поддающимися формовке. Во-вторых, металлическая связь обеспечивает металлам высокую электропроводность, так как свободные электроны могут легко передавать электрический ток.
Ионный характер связи

Ионная связь – этохимическая связь, основанный на притяжении противоположно заряженных ионов. Она образуется между металлическим и неметаллическим элементами. Ионный характер связи является типичным для металлов, так как они обладают способностью отдавать электроны и образовывать положительно заряженные ионы (катионы).
Механизм образования ионной связи состоит в том, что металлы имеют низкую электроотрицательность и поэтому электроны из валентной оболочки металла могут легко переходить на внешнюю оболочку неметалла. При этом металл становится положительно заряженным ионом (катионом), а неметалл – отрицательно заряженным ионом (анионом).
Одной из особенностей ионной связи является ее кристаллическая структура. Ионы местами, точно совмещаясь, образуют кристаллическую решетку. Такая структура обеспечивает высокую жесткость ионных кристаллов.
Свойства ионных соединений определяются их кристаллической структурой и силой ионной связи. Ионная связь обладает высокой прочностью, что объясняет высокие температуры плавления и кипения ионных соединений, а также их прочность и жесткость.
Металлическое связывание в кристаллической решетке
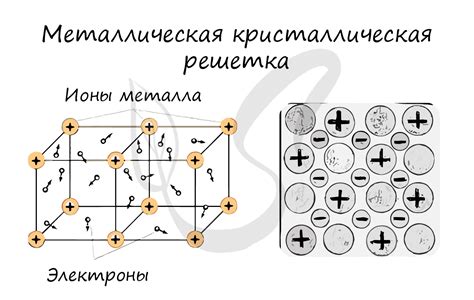
Металлическое связывание в кристаллической решетке является основной формой химической связи между атомами металлов. Оно обладает уникальными свойствами и способно обеспечивать прочность и термическую проводимость в металлических материалах.
Металлическая связь основана на обмене электронами между атомами металла. Одна или несколько валентных электронных оболочек в металлических атомах становятся общими для всей кристаллической решетки. Валентные электроны образуют некий "облако" электронов, которое окружает положительно заряженные ядра металлических атомов.
Электрическое связывание в металлической решетке обеспечивает ее прочность и устойчивость. Валентные электроны подвижны в металлической решетке, что позволяет ей проводить электрический ток и тепло. Кроме того, эти электроны могут быть отвечены отдельными атомами металла и создать положительно заряженные ионы, которые образуют кристаллическую решетку металла.
Металлическое связывание имеет свои характеристики и свойства, которые определяют специфические свойства металлических материалов, таких как высокая термическая и электрическая проводимость, высокая пластичность и прочность. Металлы имеют кристаллическую структуру, в которой атомы металла выстроены в регулярную, трехмерную решетку, связанную между собой металлическим связыванием.
Особенности электронной структуры металлов

Электронная структура металлов обладает рядом особенностей, которые делают эти материалы уникальными в плане химической связи и физических свойств. Одной из ключевых особенностей является наличие свободных электронов в зоне проводимости, которые могут свободно перемещаться по кристаллической решетке металла.
Электронная структура металлов определяет их высокую электропроводность и теплопроводность. Благодаря наличию свободных электронов, металлы обладают способностью передавать электрический и тепловой ток без значительных потерь. Это позволяет использовать металлы в различных отраслях промышленности для создания электрических проводов, разогрева изделий и других процессов, связанных с электричеством и теплом.
Кроме того, электронная структура металлов обуславливает их способность образовывать ионные связи с другими элементами. При взаимодействии с неметаллами, металлы могут отдавать свои свободные электроны, образуя положительно заряженные ионы, которые привлекают отрицательно заряженные электроны неметаллов. Такие ионные связи между металлами и неметаллами позволяют образовывать разнообразные соединения, например, соли или оксиды.
Следует отметить, что электронная структура металлов может быть изменена путем легирования, то есть введения в металлы примесных атомов других элементов. Легирование позволяет улучшить свойства металлов, например, повысить их прочность, устойчивость к коррозии или электропроводность. Это происходит за счет изменения электронной структуры и взаимодействия легирующих атомов с электронами свободной зоны проводимости или зоной запрещенных состояний.
Образование комплексных соединений

Комплексные соединения представляют собой соединения, в которых одни или несколько атомов металла связаны с лигандами - нейтральными или заряженными молекулами или ионами. Образование таких соединений возможно благодаря способности металлов к образованию координационной связи.
Процесс образования комплексных соединений основан на взаимодействии металла и лиганда. Металл может образовывать связи с несколькими лигандами, создавая структуру, называемую координационным комплексом. В координационном комплексе металл играет роль центрального иона, вокруг которого располагаются лиганды.
Образование комплексных соединений сопровождается процессом координации, при котором образуются координационные связи между металлом и лигандом. В результате образования координационной связи один или несколько атомов лиганда передает свои электроны металлу, образуя диполи или ионы. Этот процесс происходит благодаря наличию внутренних электронных оболочек у атомов металла, которые обеспечивают возможность принимать электроны от лигандов.
Образование комплексных соединений имеет широкое применение в различных областях науки и техники. Комплексы металлов с лигандами играют важную роль в катализе химических реакций, оптической иллюстрации, фармацевтической и медицинской промышленности, электронике и других отраслях.
Взаимодействие металлов с неметаллами

Металлы и неметаллы обладают разными свойствами и способами взаимодействия. Металлы вступают в химическую связь с неметаллами посредством образования ионных соединений или соединений с координационной связью. В процессе взаимодействия металлы, имеющие низкую электроотрицательность, отдают электроны неметаллам, образуя положительные ионы. Неметаллы, наоборот, принимают электроны и образуют отрицательные ионы.
Образование ионных соединений происходит при взаимодействии неметалла с металлом, у которого низкая электроотрицательность. К примеру, образование хлорида натрия NaCl - ионного соединения, в котором один атом натрия отдает электрон, становясь положительным ионом Na+, а атом хлора принимает электрон, образуя отрицательный ион Cl-. Таким образом, металлы и неметаллы в химической связи обладают противоположными зарядами.
Кроме того, взаимодействие металлов с неметаллами может происходить посредством образования соединений с координационной связью. В этом случае металлы образуют комплексы с неметаллом, в которых неметалл выступает в роли лиганда, то есть образует координационные связи с металлом путем образования дативной связи. Примером такого взаимодействия является образование комплекса сияния CuSO4 · 5H2O, в котором атом меди образует пятикратную координационную связь с атомами кислорода и молекулами воды.
Интересно отметить, что взаимодействие металлов с неметаллами имеет важное значение в различных сферах науки и техники, включая катализ, электрохимию, металлургию и другие области. Это связано с уникальными свойствами и химическими реакциями, которые возникают при взаимодействии металлов и неметаллов.
Специфика химической связи в переходных металлах

Переходные металлы - это элементы, расположенные в блоке д-элементов периодической таблицы. Одной из особенностей химической связи в переходных металлах является их способность образовывать сложные соединения с различными лигандами.
Сложные соединения переходных металлов характеризуются наличием центрального атома металла, который окружен лигандами - атомами или группами атомов, образующими электронные пары, образующие химическую связь с металлом. Лиганды могут быть различной природы, иметь разные заряды и органическую структуру, что позволяет переходным металлам образовывать богатый спектр соединений.
Переходные металлы также обладают большим числом электронов в своей внешней электронной оболочке, что позволяет им образовывать различные типы химической связи. Например, они могут формировать ионные, ковалентные и металлические связи. Это обеспечивает переходным металлам разнообразие в их химической активности и способность к образованию стабильных соединений.
Химическая связь в переходных металлах обладает большой прочностью и устойчивостью, что позволяет этим элементам образовывать структуры с высокой температурной и химической стойкостью. Это делает переходные металлы ценными для применения в различных отраслях промышленности, таких как катализ, электроника, металлургия и другие.
Выводя химическую связь в переходных металлах на новый уровень, исследователи постоянно открывают новые свойства и возможности этих элементов. Изучение и понимание специфики и механизма образования химической связи в переходных металлах имеет важное значение для развития науки и применения этих материалов в различных сферах человеческой деятельности.
Вопрос-ответ

Какие особенности имеет химическая связь металлов?
Химическая связь металлов отличается от связи в молекулах органических соединений. В связи металлов валентные электроны металла образуют электронное облако, которое общими усилиями держится вокруг положительно заряженных ионов металла. Это создает так называемую "металлическую связь", которая характеризуется высокой проводимостью электрического тока и тепла, а также пластичностью и металлическим блеском.
Каким образом образуется химическая связь металлов?
Химическая связь металлов образуется благодаря электростатическому притяжению между положительно заряженными ионами металла и электронами, образующими электронное облако. Валентные электроны металла образуют "море" электронов, в котором положительные ионы находятся. Такая связь обладает особенностями, такими как высокая проводимость электрического тока, пластичность и возможность образования различных кристаллических структур в металлах.
