Коррозия металлов – это процесс разрушения металлов под воздействием окружающей среды, который приводит к потере их механических свойств и структурных изменений. Это явление является важной проблемой в инженерии и строительстве, поскольку может привести к серьезным последствиям, включая аварии и снижение долговечности металлических конструкций.
Агрессивные среды, такие как кислоты, играют значительную роль в процессе коррозии металлов. Кислоты могут проникать в металл, разрушать его структуру и вызывать реакции, которые нарушают его связи. В результате могут образовываться дыры, трещины и другие дефекты, что приводит к дальнейшему разрушению материала.
Серная кислота (H2SO4) является одной из наиболее агрессивных кислот, используемых для коррозии металлов. Оная обладает высокой концентрацией и химической активностью, которая позволяют ей взаимодействовать с большим числом металлов. В частности, серная кислота может разрушить алюминий, железо, никель и другие металлы, что делает ее универсальным инструментом для изучения коррозии.
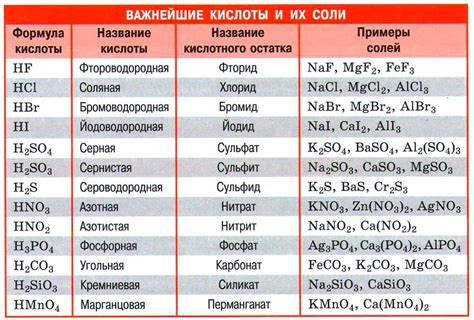
Также, стоит отметить, что соляная кислота (HCl) является одной из наиболее распространенных и эффективных кислот для коррозии металлов. Она обладает высокой реакционной способностью и может разрушать такие металлы, как железо, алюминий, цинк и другие. Более того, соляная кислота может использоваться для удаления ржавчины и других продуктов коррозии с поверхности металлов.
Итак, серная кислота и соляная кислота являются двумя главными кислотами, которые часто используются для изучения коррозии металлов. Их химическая активность и высокая концентрация делают их эффективными инструментами для разрушения металлических конструкций и исследования процессов коррозии.
Кислоты и их влияние на коррозию металлов

Коррозия металлов является распространенной проблемой, которая может привести к серьезным повреждениям и потере структурной прочности. Различные кислоты могут быть одним из факторов, которые способствуют коррозии металлов. Они воздействуют на металлическую поверхность, вызывая разрушение за счет окисления и растворения металла.
Одной из наиболее эффективных кислот для коррозии металлов является серная кислота (H2SO4). Она широко используется в промышленности для удаления оксидов и других загрязнений с металлических поверхностей. Серная кислота способна разрушить слой оксида на поверхности металла, что позволяет ей проникнуть внутрь и вызвать повреждение металла.
Еще одной опасной кислотой для коррозии металлов является соляная кислота (HCl). Она обладает сильными коррозионными свойствами и может вызвать разрушение металлических поверхностей. Соляная кислота используется в различных промышленных процессах, таких как производство химических веществ, очистка металла от загрязнений и т. д.
Фосфорная кислота (H3PO4) также может способствовать коррозии металлов. Она может растворять некоторые металлы, такие как алюминий, вызывая повреждение структуры металла. Фосфорная кислота используется в различных отраслях промышленности, включая производство удобрений, электронику и металлообработку.
Коррозия металлов вызвана взаимодействием с кислотами может быть серьезной проблемой, и поэтому необходимы соответствующие меры предосторожности при работе с этими веществами. Регулярная проверка и техническое обслуживание металлических конструкций, а также использование защитных покрытий и материалов могут помочь предотвратить коррозию и обеспечить длительный срок службы металлических изделий.
Катодная и анодная реакции при взаимодействии кислот с металлами

Катодная и анодная реакции являются ключевыми процессами при взаимодействии кислот с металлами. Катодная реакция представляет собой процесс восстановления ионов водорода (Н+) к минимальной энергии, что приводит к выделению водорода на поверхности металла. Эта реакция происходит на поверхности металла после его ионизации.
Анодная реакция, напротив, представляет собой процесс окисления металла и образования положительных ионов металла, которые переходят в раствор кислоты. Анодные реакции протекают на поверхности металла после их окисления и их энергия возрастает.
При взаимодействии кислот с металлами может происходить как катодная, так и анодная реакция. Например, при взаимодействии соляной кислоты (HCl) с металлами происходит образование солей соответствующих металлов и выделение водорода. В этом случае клетка выглядит следующим образом: 2H+ (катод) + 2e- → H2 (газ) (катодная реакция); M (металл) → Mn+ + ne- (анодная реакция), где n - число электронов, необходимых для окисления металла.
Коррозия металлов при воздействии кислот происходит за счет анодных реакций, так как металл окисляется, образуя положительные ионы, которые растворяются в кислотном среде. При этом катодные реакции нейтрализуются выделением водорода. Кислоты, содержащие анионы, обладающие большей восстановительной способностью, являются особенно эффективными для коррозии металлов.
Сильные кислоты и их разрушительное влияние на металлы
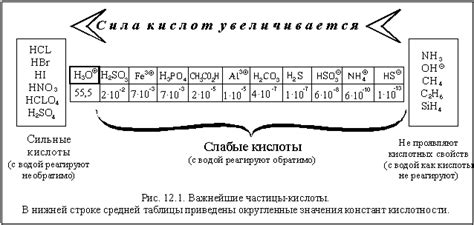
Взаимодействие металлов с кислотами является важной проблемой в области материаловедения и инженерии. Сильные кислоты могут вызывать серьезную коррозию и разрушение металлических поверхностей, что ведет к сокращению срока службы металлических конструкций и устройств.
Одной из наиболее опасных кислот для металлов является серная кислота (H2SO4). Она обладает высокой агрессивностью и может вызывать разрушение металлических поверхностей даже при низкой концентрации. Серная кислота атакует различные металлы, включая железо, алюминий, медь и свинец, приводя к образованию сульфатов и выщелачиванию металлических ионов.
Еще одной сильной кислотой, способной вызывать коррозию металлов, является азотная кислота (HNO3). Она особенно агрессивна по отношению к меди и ее сплавам, таким как латунь. Взаимодействие азотной кислоты с медью приводит к образованию нитратов и нитритов, которые разлагаются с выделением ядовитых газов, таких как оксиды азота.
Фторидные кислоты также обладают сильным коррозионным воздействием на некоторые металлы. Например, фтороводородная (плавиковая) кислота (HF) может разрушать стекло и керамику, а также ряд металлов, включая алюминий и титан. Для защиты от коррозии при работе с фторидными кислотами требуются специальные материалы, такие как нержавеющая сталь или пластиковые противохимические материалы.
Важно отметить, что коррозионная активность кислот зависит не только от их концентрации, но и от других факторов, таких как температура, вязкость, агрессивность окружающей среды и тип поверхности металла.
Органические кислоты: особенности и их воздействие на коррозию
Органические кислоты - это класс химических соединений, которые содержат карбоксильную группу (-COOH). Они широко используются в промышленности и научных исследованиях, однако их воздействие на металлы может быть разрушительным.
Органические кислоты обладают высокой активностью из-за наличия карбоксильной группы, которая может разрывать химические связи между атомами металла. Это приводит к образованию коррозии - процесса разрушения металла под воздействием окружающей среды.
Влияние органических кислот на коррозию металлов зависит от их свойств, таких как концентрация, pH-уровень, температура и присутствие других веществ. Некоторые органические кислоты, такие как уксусная кислота и молочная кислота, могут вызывать быструю коррозию металлов, особенно в условиях повышенной температуры и влажности.
Однако, не все органические кислоты имеют сильное воздействие на коррозию металлов. Некоторые органические кислоты, такие как олеиновая кислота и стеариновая кислота, могут быть использованы в качестве противокоррозионных добавок для металлических поверхностей. Они формируют защитную пленку на поверхности металла, которая предотвращает проникновение влаги и кислорода, что способствует уменьшению коррозии.
В общем, при работе с органическими кислотами необходимо учитывать их влияние на металлы и принимать меры по защите поверхностей от коррозии. Это может включать использование защитных покрытий, специальных добавок или выбор металлов, устойчивых к воздействию органических кислот.
Соли кислот: защита или дополнительная опасность для металлов?
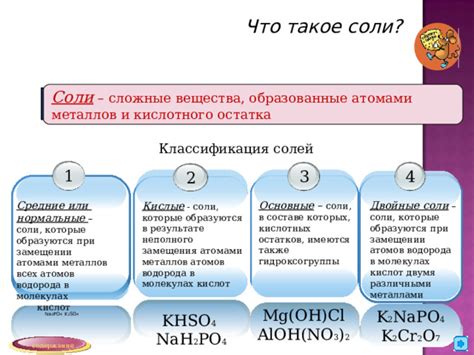
Взаимодействие металлов с кислотами является распространенным явлением в химии. Однако, не только непосредственное воздействие кислот на металлы может вызывать их коррозию. Особое внимание следует уделить солям кислот, которые могут стать как защитой, так и источником дополнительной опасности для металлов.
В зависимости от конкретных условий и состава солей, они могут проявлять как противокоррозионные свойства, так и способствовать разрушению металлов. Например, некоторые соли кислот могут образовывать на поверхности металла защитные пленки, которые предотвращают дальнейшую коррозию. Такие соли, как хроматы, фосфаты и нитриты, могут использоваться для создания противокоррозионных покрытий.
Однако, соли кислот также могут стать источником опасности для металлов. Некоторые соли, например, хлориды и сульфаты, могут активно проникать в структуру металла и вызывать обратные электрохимические процессы, приводящие к его разрушению. Более того, взаимодействие солей кислот с металлами может приводить к образованию коррозийных процессов, поглощению металла и значительному сокращению срока его эксплуатации.
Важно отметить, что воздействие солей кислот на металлы может быть сложным, многогранным и зависит от множества факторов, таких как концентрация солей, температура, наличие других веществ и т.д. Поэтому, для эффективной защиты металлов от коррозии необходимо учитывать все эти факторы и выбирать соответствующие меры предосторожности.
Выбор оптимальной кислоты для защиты металлических конструкций

Коррозия металлов является одной из основных проблем, с которыми сталкиваются металлургические и строительные предприятия.
Чтобы предотвратить разрушение металлических конструкций, необходимо использовать эффективные методы защиты, одним из которых является применение специальных кислот.
Оптимальный выбор кислоты для защиты металла зависит от его химической природы и степени подверженности коррозии. Например, серная кислота является одним из наиболее распространенных агентов для удаления окислов и ржавчины с поверхности металла. Она эффективно взаимодействует с окисными пленками, разрушает их и предотвращает дальнейшее развитие коррозии.
Фосфорная кислота также является эффективной для защиты металлических конструкций. Она образует покрытие на металлической поверхности, которое препятствует контакту с агрессивными средами, такими как кислоты или щелочи. Покрытие фосфорной кислоты также уменьшает скорость коррозии и повышает стойкость металлического изделия к воздействию окружающей среды.
Однако, выбор оптимальной кислоты для защиты металлических конструкций должен быть основан на комплексном анализе, учитывающем условия эксплуатации и требования к конечному продукту. Например, для конструкций, эксплуатируемых в агрессивной среде, возможно применение более концентрированных и агрессивных кислот, таких как хлороводородная или азотная кислоты. Они обладают высокой активностью и обеспечивают надежную защиту металлической поверхности.
Применение кислот в промышленности для контроля коррозии
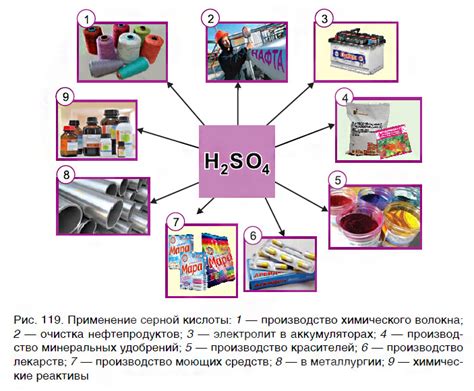
Коррозия металлов – это процесс разрушения металлической поверхности под воздействием окружающей среды. Для предотвращения этого процесса в промышленности широко применяются различные кислоты.
Сольфатная кислота, или серная кислота (H2SO4), является одной из самых эффективных кислот для контроля коррозии металлов. Используется она, в основном, для обработки стальных поверхностей, так как образующиеся при этом сульфаты образуют прочный защитный слой на поверхности металла.
Нитратная кислота (HNO3) также применяется для контроля коррозии. Она широко используется для обработки алюминия, так как образуется плотная оксидная пленка, которая предотвращает дальнейший разрушительный процесс.
Фосфорная кислота (H3PO4) успешно используется для обработки металлов, таких как железо и его сплавы. Фосфаты, образующиеся в результате взаимодействия фосфорной кислоты с поверхностью металла, создают защитный слой, который предотвращает коррозию.
Азотистая кислота (HNO2) применяется для обработки цинка и его сплавов. Реакция азотистой кислоты с поверхностью металла приводит к образованию плотной нитридной пленки, предотвращающей коррозию.
- Сольфатная кислота (H2SO4)
- Нитратная кислота (HNO3)
- Фосфорная кислота (H3PO4)
- Азотистая кислота (HNO2)
Применение данных кислот в промышленности позволяет эффективно контролировать коррозию металлических поверхностей и предотвращать разрушительные процессы.
Вопрос-ответ

Какие кислоты рекомендуются использовать для быстрой коррозии металлов?
Для быстрой коррозии металлов рекомендуется использовать агрессивные кислоты, такие как соляная кислота (HCl) и азотная кислота (HNO3). Они обладают высокой активностью и способны быстро разрушить металлическую структуру.
Какие кислоты могут вызывать коррозию алюминия?
Алюминий может корродировать под воздействием некоторых кислот, таких как соляная кислота (HCl), серная кислота (H2SO4) и некоторые аминокислоты. Эти кислоты могут разрушать пассивную защитную оксидную пленку на поверхности алюминия, что приводит к его коррозии.
Какие кислоты рекомендуется использовать для коррозии стали?
Для коррозии стали рекомендуется использовать кислоты, которые разрушают защитную оксидную пленку на поверхности металла. Некоторые из них включают соляную кислоту (HCl), фосфорную кислоту (H3PO4) и аминокислоты. Они эффективно атакуют сталь и способствуют её коррозии.
Какие кислоты могут разрушать цинк?
Цинк может быть разрушен под действием кислот, таких как соляная кислота (HCl), серная кислота (H2SO4) и азотная кислота (HNO3). Они реагируют с поверхностью цинка, разрушая его структуру и вызывая коррозию.
Какие кислоты не вызывают коррозию меди?
Медь обладает хорошей коррозионной стойкостью и не реагирует со многими кислотами. Однако, некоторые кислоты, такие как соляная кислота (HCl) и азотная кислота (HNO3), могут вызывать коррозию меди при достаточно высокой концентрации и при продолжительном воздействии.
