Металлы - это особый класс элементов, обладающих высокой электропроводностью, гибкостью, прочностью и другими уникальными химическими свойствами. Среди металлов наиболее активным является элемент с атомным номером 11 - натрий (Na).
Электронная формула натрия показывает распределение электронов в его атоме. Натрий имеет электронную конфигурацию 1s² 2s² 2p⁶ 3s¹. Это означает, что у натрия есть 11 электронов, распределенных на несколько энергетических уровней и подуровней.
За счет наличия одного электрона на внешнем энергетическом уровне (3s), натрий обладает высокой активностью. Этот электрон охотно участвует в химических реакциях, выходя из атома и образуя положительный ион Na⁺. Таким образом, натрий легко образует соединения с другими элементами, особенно с хлором, кислородом и серой.
Натрий широко применяется в промышленности, медицине, пищевой промышленности и других отраслях. Его соединения используются в производстве стекла, мыла, сыра, а также в качестве консервантов и пищевых добавок. Благодаря своей активности и уникальным химическим свойствам, натрий играет важную роль в различных сферах нашей жизни.
Электронная формула натрия помогает понять причины его химической активности и способности образовывать соединения. Изучение электронных формул других элементов позволяет лучше понять их свойства и использовать их в различных областях науки и техники.
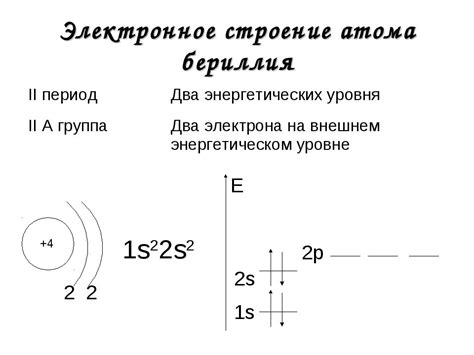
Электронная формула лития - наиболее активного металла

Литий - элемент периодической таблицы, относящийся к группе щелочных металлов. Он считается наиболее активным металлом, что связано с его электронной формулой.
Электронная формула лития можно записать как 1s22s1. Это означает, что у атома лития на первом энергетическом уровне находятся два электрона, а на втором энергетическом уровне - один электрон.
Именно эта электронная конфигурация делает литий наиболее активным металлом. Второй энергетический уровень лития содержит только один электрон, что делает его очень нестабильным. Литий стремится отдать этот электрон и прийти в состояние, когда на внешнем энергетическом уровне будет два электрона. Это позволяет литию образовывать легко ионизирующиеся положительные ионы с зарядом +1.
Ионизация лития может выглядеть следующим образом: Li -> Li+ + e-. В этом случае, литий отдает свой один электрон и превращается в положительно заряженный ион.
Активность лития связана не только с его электронной формулой, но и с его относительно низкой ионизационной энергией. Чем ниже ионизационная энергия, тем легче атому отдать электрон и образовать ион. В случае с литием, его ионизационная энергия составляет всего около 520 кДж/моль, что делает его очень активным элементом.
Структура электронной формулы
Электронная формула наиболее активного металла представляет собой представление распределения электронов в его внешней электронной оболочке. Она помогает нам понять, по какому принципу металл взаимодействует с другими элементами и какие реакции может совершать.
Основой электронной формулы является символ металла, за которым следует индекс, обозначающий количество электронов в его внешней электронной оболочке. Например, электронная формула для натрия (Na) выглядит как "Na1", что означает, что в его внешней оболочке находится 1 электрон.
Количество электронов во внешней оболочке металла определяет его активность. Чем больше электронов во внешней оболочке, тем менее активен металл, так как он не очень стремится отдавать или принимать электроны. Наоборот, если внешняя оболочка металла содержит меньше электронов, он становится более активным и может легко отдавать электроны в реакциях.
Очень активные металлы, такие как литий (Li) или калий (K), имеют всего один электрон во внешней электронной оболочке. Поэтому они стремятся отдать этот электрон и стать положительно заряженными ионами. С другой стороны, менее активные металлы, такие как цинк (Zn) или железо (Fe), имеют больше электронов во внешней оболочке и не так легко отделяют их в реакциях.
Важно помнить, что электронная формула наиболее активного металла дает нам только общую информацию о его химических свойствах. Другие факторы, такие как давление, температура и наличие других элементов, также могут влиять на его активность и способность участвовать в химических реакциях.
Особенности электронного строения
Электронное строение химических элементов определяет их физические и химические свойства. В основе электронного строения лежит распределение электронов по энергетическим уровням и подуровням, которые определяют, как атом взаимодействует с другими атомами в процессе химических реакций.
Наиболее активные металлы относятся к первой группе периодической таблицы, таким как литий, натрий и калий. Эти металлы имеют одну электрон в своей внешней оболочке, что делает их очень реактивными. Однако, не все металлы с одним внешним электроном являются такими же активными. Например, медь, находящаяся в той же группе, имеет электронную формулу 3d104s1 и проявляет меньшую реактивность.
Другим фактором, влияющим на активность металлов, является размер атома. Чем меньше атом, тем сильнее притягиваются его электроны к ядру, что делает металл более реактивным. Например, литий имеет наименьший радиус среди металлов первой группы и является самым активным из них.
Также стоит отметить, что электронное строение металлов может варьироваться в зависимости от окружающей среды или наличия соседних атомов. Вследствие этого, металлы могут проявлять различные свойства в разных химических соединениях.
Активность в химических реакциях

Активность — это свойство химических элементов или соединений проявлять высокую химическую реакционную способность при взаимодействии с другими веществами. Активные элементы обладают высокой электроотрицательностью и являются хорошими окислителями или восстановителями в химических реакциях.
Наиболее активный металл в периодической таблице элементов - франций (Fr). Франций является самым редким и самым тяжелым щелочным металлом, обладающим самой низкой электроотрицательностью среди всех элементов.
В связи с высокой активностью металлов, они становятся причиной многих химических реакций. Они активно вступают во взаимодействие с кислородом, водой, кислотами и другими веществами. Например, калий (K), натрий (Na) и литий (Li) реагируют с водой, образуя гидроксиды металлов и выделяя водород. Цезий (Cs) и рубидий (Rb) могут воспламеняться при контакте с воздухом.
Активность металлов можно определять и по их электронной формуле. Щелочные и щелочноземельные металлы имеют один валентный электрон во внешней электронной оболочке, что делает их более реакционноспособными в сравнении с другими металлами.
Однако, активность металлов может сказываться и на их стабильности, так как активные металлы имеют большую склонность к окислению. Поэтому, активные металлы обычно хранят под слоем инертного газа или в вакууме, чтобы предотвратить контакт с воздухом и окисление.
Способы получения лития
Электролиз солей: Один из основных способов получения лития – это электролиз солей. Для этого применяются растворы солей лития, таких как литиевые хлорид, литиевый фторид и литиевые гидроксиды. В процессе электролиза металлическое литий осаждается на катоде, а соли лития разлагаются.
Термическое восстановление: Еще одним способом получения лития является термическое восстановление оксидов или галогенидов лития. При нагревании этих соединений до высоких температур они разлагаются, и металлический литий выделяется в виде паров или осаждается на холодных поверхностях.
Извлечение из воды: Литий также можно получить из воды. Вода, содержащая литий, подвергается электролизу или проходит процесс фильтрации и экстракции, в результате чего получают металлический литий.
Извлечение из руды: Одним из сложных способов получения лития является его извлечение из руды. Руда, содержащая литий, пропускается через смеситель и подвергается обжигу при высоких температурах. В результате обжига образуется оксид лития, который затем может быть подвергнут дополнительной обработке для получения металлического лития.
Таким образом, существуют различные способы получения лития, включая электролиз солей, термическое восстановление, извлечение из воды и извлечение из руды. Выбор подходящего способа зависит от доступных исходных материалов и требуемых характеристик получаемого металла.
Применение лития в промышленности

Литий - один из наиболее активных металлов, который обладает широким спектром применения в промышленности. Его уникальные свойства делают его незаменимым материалом во многих отраслях.
В первую очередь, литий используется в производстве аккумуляторов. Он является ключевым компонентом литий-ионных аккумуляторов, которые активно применяются в мобильных устройствах, ноутбуках, автомобильной промышленности и даже в хранении возобновляемой энергии.
Кроме того, литий используется в производстве керамических и стеклянных изделий. Специальная формула с добавлением лития позволяет получить материалы с высокой прочностью и термостойкостью. Это делает такие изделия идеальными для использования в электротехнике и электронике, где требуется высокая стабильность и надежность.
Также литий находит применение в производстве сплавов и легированных металлов. Он является важным компонентом при создании алюминиевых сплавов, которые обладают высокой прочностью и легкостью. Это позволяет использовать их в авиационной и автомобильной промышленности, что значительно улучшает технические характеристики и эксплуатационные свойства изделий.
Наконец, литий находит применение в фармацевтической промышленности. Он используется как активный компонент в некоторых лекарственных препаратах, которые применяются для лечения биполярного расстройства и депрессии. Благодаря своим свойствам, литий оказывает успокаивающее и стабилизирующее действие на психику пациента.
В целом, литий является неотъемлемой частью промышленности и находит применение во многих отраслях. Его уникальные свойства делают его незаменимым материалом для создания различных изделий, сплавов и лекарственных препаратов.
Значение лития для организма

Литий — микроэлемент, который играет важную роль в поддержании здоровья организма. Человеческое тело не может синтезировать литий самостоятельно, поэтому для его получения необходимо употреблять продукты, богатые этим элементом.
Положительное влияние лития на организм:
- Стабилизация настроения: литий способствует предотвращению и снижению симптомов депрессии и биполярного аффективного расстройства. Он улучшает настроение, помогает справиться с тревожностью и раздражительностью.
- Поддержание нервной системы: литий оказывает успокаивающее и антистрессовое действие на нервную систему, снижая уровень агрессии и тревожности. Он также повышает уровень серотонина, гормона счастья.
- Улучшение памяти и концентрации: литий способствует улучшению когнитивных функций, таких как память, внимание и мышление. Он также помогает предотвратить развитие некоторых неврологических заболеваний, таких как болезнь Альцгеймера.
- Поддержание здоровья сердца: литий снижает риск развития сердечно-сосудистых заболеваний, таких как артериальная гипертония и инсульт. Он стимулирует работу сердца и улучшает состояние сосудов.
Однако необходимо помнить, что дозировка лития должна быть строго контролируемой, поскольку его избыточное потребление может вызвать негативные побочные эффекты, такие как дисбаланс электролитов и проблемы с почками. Поэтому перед началом приема литиевых препаратов необходимо проконсультироваться с врачом и соблюдать рекомендации по дозировке.
Области применения активного металла

Активные металлы широко используются в различных отраслях промышленности благодаря своим уникальным свойствам. Они обладают высокой реактивностью и способностью к химическим реакциям, что делает их неотъемлемыми компонентами во многих процессах.
Одной из главных областей применения активных металлов является производство их сплавов. Эти сплавы используются в авиационной и автомобильной промышленности, машиностроении, производстве электроники и других отраслях. Активные металлы, такие как магний, алюминий и титан, обладают высокой прочностью и легкостью, что делает их идеальными материалами для создания легких и прочных конструкций.
Другой важной областью применения активных металлов является производство батарей и аккумуляторов. Они используются в электрошокерах, мобильных устройствах, электромобилях и других устройствах, которые требуют энергоснабжения из внешних источников. Литий, калий и другие активные металлы являются ключевыми компонентами в этих устройствах благодаря своей способности эффективно хранить и передавать энергию.
Активные металлы также находят применение в производстве катализаторов. Они используются в химической промышленности для ускорения различных химических процессов и улучшения качества продукции. Например, натрий и калий являются важными компонентами при производстве синтетических удобрений, а ртуть используется в катализаторах при производстве полимеров.
Также активные металлы применяются в производстве огнетушителей. Они используются для тушения различных типов пожаров благодаря своей реактивности с кислородом и высокой энергии, выделяемой при химической реакции. Калий, натрий и другие активные металлы представлены в виде порошка или специальных соединений в составе огнетушащих веществ.
Таким образом, активные металлы нашли свое применение во многих областях промышленности и науки благодаря своему высокой активности и уникальным свойствам. Они позволяют создавать новые материалы и устройства, способствуя развитию технологий и прогрессу человечества.
Влияние лития на окружающую среду

Литий - это химический элемент, который является наиболее активным металлом. Его использование в различных областях может иметь как положительное, так и отрицательное воздействие на окружающую среду.
- Электронные устройства: Литиевые батареи широко используются в портативных электронных устройствах, таких как смартфоны и ноутбуки. Однако, если они не утилизируются правильным образом, то литий может проникать в почву и воду, оказывая негативное влияние на окружающую среду и животный и растительный мир.
- Переработка литиевых батарей: Правильная переработка литиевых батарей является важным шагом для минимизации их отрицательного воздействия на окружающую среду. В настоящее время разрабатываются специальные технологии для эффективной переработки и вторичного использования литиевых батарей.
- Промышленное использование: Литий используется в производстве стекла и керамики, а также в производстве легких сплавов и литиевых солей. Выбросы лития в атмосферу или водные источники в процессе его добычи и производства могут быть вредными для окружающей среды.
В целом, влияние лития на окружающую среду зависит от способа его использования и правильной переработки. Активные усилия в направлении разработки экологически-нейтральных методов использования и переработки лития помогут минимизировать его отрицательное воздействие на окружающую среду и создать более устойчивую и экологически безопасную будущую среду.
Вопрос-ответ

Какая электронная формула наиболее активного металла?
Электронная формула наиболее активного металла - K [2,8,8,1].
Какими характеристиками обладает наиболее активный металл?
Наиболее активный металл обладает следующими характеристиками: легко окисляется, образует ионы с положительными зарядами, реактивен, обладает высокой электроотрицательностью.
Какие еще металлы считаются активными?
Помимо наиболее активного металла - калия, также считаются активными металлы такие элементы, как натрий, литий, цезий.
Что происходит, когда активный металл взаимодействует с кислородом?
Когда активный металл взаимодействует с кислородом, происходит окисление металла. Химическое взаимодействие приводит к образованию оксида металла.
Какие свойства активных металлов могут использоваться в промышленности?
Свойства активных металлов, такие как реактивность и высокая электроотрицательность, могут быть использованы в промышленности для проведения различных химических реакций и производства различных материалов и соединений.
