Азотная кислота (HNO3) является одним из наиболее распространенных и активных химических соединений. При взаимодействии с металлами она способна вызывать различные реакции, как в концентрированном, так и в разбавленном виде.
В концентрированной азотной кислоте происходит окисление металлов до ионного состояния, что сопровождается образованием окислов и диоксида азота (NO2). Также наблюдается эффект растворения металлов, что приводит к образованию соответствующих солей азотной кислоты. Некоторые металлы, такие как медь, свинец и серебро, реагируют с азотной кислотой не только в горячем, но и в холодном состоянии.
Разбавленная азотная кислота (обычно 50% концентрации) взаимодействует с металлами гораздо менее активно, так как ее окислительные свойства снижаются. Однако, некоторые металлы, такие как медь и свинец, все равно реагируют с разбавленной кислотой, образуя соответствующие соли и освобождая диоксид азота. В этом случае скорость реакции существенно меньше, чем при взаимодействии с концентрированной формой кислоты.
Взаимодействие металлов с концентрированной азотной кислотой

Азотная кислота, или HNO3 – это одна из самых сильных кислот, которая широко используется в химической промышленности и лабораториях. Концентрированная азотная кислота обладает высокой степенью коррозии и может взаимодействовать с различными металлами.
Взаимодействие металлов с концентрированной азотной кислотой является окислительно-восстановительной реакцией, в результате которой образуются соли азотной кислоты и освобождается диоксид азота. Такая реакция может протекать между такими металлами, как медь, железо, алюминий и цинк.
Однако не все металлы одинаково реагируют с концентрированной азотной кислотой. Например, медь при взаимодействии с кислотой может образовывать сульфат меди и оксиды азота. Железо же может образовывать нитрат железа(III) и аммиак. Реакция с алюминием приводит к образованию нитрата алюминия и оксидов азота, а цинк образует нитрат цинка и аммиак.
Особенностью взаимодействия металлов с концентрированной азотной кислотой является быстрота процесса. Реакция может протекать очень быстро, с выделением тепла и газов. При этом важно соблюдать меры предосторожности, так как такое взаимодействие может быть опасным и приводить к образованию высокотоксичных испарений и взрывам. Данная реакция также может применяться в химическом анализе для определения наличия и количества металлов в пробе.
Опасность использования концентрированной азотной кислоты

Концентрированная азотная кислота является одним из самых опасных химических веществ, которые могут быть использованы в лабораторных условиях. Она обладает высокой степенью коррозии и окисления, что делает ее крайне опасной для сотрудников и окружающей среды.
При попадании концентрированной азотной кислоты на кожу или слизистые оболочки происходит неконтролируемое разрушение тканей, что может привести к серьезным ожогам и даже требовать хирургического вмешательства. При ингаляции паров азотной кислоты возникает риск поражения дыхательных путей, а в случае попадания в глаза - возможно потеря зрения.
Концентрированная азотная кислота также может вызывать пожары и взрывы при неправильном хранении или смешивании с другими химическими веществами. Более того, она реагирует со многими органическими и неорганическими веществами, образуя взрывоопасные смеси.
Особенно важно соблюдать осторожность при работе с концентрированной азотной кислотой, так как она является одним из основных компонентов взрывчатых смесей, используемых в производстве взрывчатки. Взаимодействие азотной кислоты с металлами, например, алюминием, свинцом или железом, может привести к самовозгоранию и в процессе образования взрывоопасных соединений.
Таким образом, использование концентрированной азотной кислоты требует строгого соблюдения мер предосторожности и постоянного контроля, включая работу в специально оборудованных помещениях, использование соответствующей защитной среды и экипировки, а также выбор безопасных методов и приборов для работы с этим веществом.
Протекание химических реакций с металлами
Химические реакции с металлами включают взаимодействие металлов с различными веществами, в том числе и азотной кислотой. Благодаря этим реакциям металлы могут претерпевать окисление, образуя оксиды, нитраты и другие соединения, что может существенно изменять их свойства и электрохимическую активность.
Взаимодействие металлов с азотной кислотой происходит посредством реакции окисления. При этом металлы отдают электроны, а азотная кислота выступает в качестве окислителя. В результате образуются нитраты металлов и соответствующие оксиды.
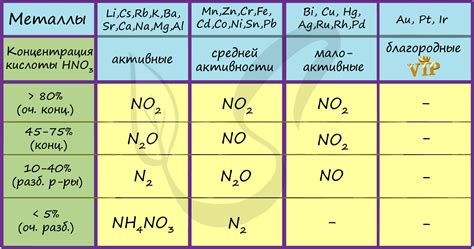
Интенсивность реакции металлов с азотной кислотой зависит от их степени активности. Некоторые металлы, такие как магний или алюминий, реагируют с азотной кислотой очень быстро, вследствие своей большой химической активности. Другие металлы, такие как золото или платина, не реагируют с азотной кислотой при обычных условиях.
Также важным фактором, влияющим на протекание реакций, является концентрация азотной кислоты. При низких концентрациях азотной кислоты реакции могут протекать медленно или не протекать вообще. Однако, при высокой концентрации азотной кислоты можно наблюдать более интенсивное взаимодействие металлов и более быстрое образование соответствующих продуктов.
Взаимодействие металлов с разбавленной азотной кислотой
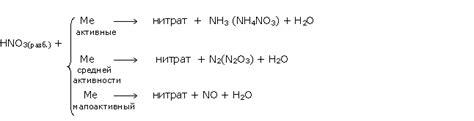
Разбавленная азотная кислота, или HNO3, является одной из самых распространенных и сильных кислот. Многие металлы взаимодействуют с ней, образуя соответствующие нитраты и освобождаяся водород.
Основными металлами, которые реагируют с разбавленной азотной кислотой, являются железо, цинк, алюминий и свинец. Взаимодействие этих металлов с HNO3 происходит по следующей схеме: металл + HNO3 → NO2 + H2O + металлический нитрат.
При взаимодействии азотной кислоты с железом образуется железный нитрат (Fe(NO3)3), который имеет светло-желтый цвет. Реакция протекает с выделением коричневого окисла азота (NO2) и выделением небольшого количества газообразного водорода.
Алюминий и цинк образуют соответствующие нитраты (Al(NO3)3 и Zn(NO3)2), и эти реакции также происходят с выделением газообразного водорода. Однако, реакция алюминия с HNO3 происходит гораздо медленнее, чем с цинком.
Свинец при взаимодействии с разбавленной азотной кислотой также образует свинцовый нитрат (Pb(NO3)2). Реакция происходит с выделением газообразного водорода, а также образованием черной и белой осадков.
Таким образом, взаимодействие металлов с разбавленной азотной кислотой является химической реакцией, при которой образуются металлические нитраты и выделяется водород. На эту реакцию влияют различные факторы, включая концентрацию кислоты, температуру и вид металла.
Реакции металлов с разбавленной азотной кислотой
Разбавленная азотная кислота обладает сильной окислительной активностью, поэтому при взаимодействии с металлами происходят химические реакции. Однако не все металлы взаимодействуют с азотной кислотой одинаково.
Одной из характерных реакций металлов с разбавленной азотной кислотой является образование соответствующих нитратов. При этом нитрат металла образуется за счет окисления металла, а кислород из азотной кислоты присоединяется к воде и образуется подвижная концентрированная азотная кислота. Такие реакции происходят, например, с медью, железом, алюминием и цинком.
Некоторые металлы, например, медь и железо, могут реагировать с азотной кислотой только при нагревании. При этом образуется оксид металла, который представляет собой белое или желтоватое соединение. Например, медь при нагревании с азотной кислотой образует смесь двух оксидов Cu2O и CuO.
Реакция цинка с разбавленной азотной кислотой происходит быстро и сопровождается выделением белого облака парами азотной кислоты и образованием растворимого нитрата цинка. При этом цинк окисляется до ионов двухвалентного цинка.
Алюминий при взаимодействии с азотной кислотой образует нитрат алюминия и выделяет аммиак NH3. Реакция алюминия с разбавленной азотной кислотой протекает медленно, но энергично, с выделением парами азотной кислоты.
Таким образом, реакции металлов с разбавленной азотной кислотой проявляются в окислительных свойствах кислоты, которая способна окислять металлы и образовывать соответствующие нитраты.
Применение разбавленной азотной кислоты в промышленности

Разбавленная азотная кислота (HNO3) широко применяется в различных отраслях промышленности благодаря своим уникальным химическим свойствам. Этот важный химический продукт играет ключевую роль в процессах производства удобрений, красителей, пластиков, взрывчатых веществ и других продуктов.
Одним из наиболее распространенных применений разбавленной азотной кислоты является производство азотных удобрений. С помощью этого соединения выпускаются аммиак и аммиачные соли, которые содержат азот, необходимый для роста растений. Азотные удобрения играют важную роль в сельском хозяйстве, повышая урожайность и качество сельскохозяйственных культур.
Кроме того, разбавленная азотная кислота находит применение в производстве красителей и пигментов. Она используется для окрашивания тканей и волокон, а также при производстве красок для различных поверхностей. Азотная кислота способна взаимодействовать с различными веществами, создавая разнообразные оттенки и цвета.
В промышленности разбавленная азотная кислота также применяется при производстве пластиков и синтетических материалов. Она является важным компонентом при синтезе нейлонов, акрила и других полимеров. Эти материалы широко используются в производстве различных продуктов, включая пленки, волокна, пластиковые изделия и многое другое.
Взаимодействие металлов с разбавленной азотной кислотой также имеет применение в промышленности. Некоторые металлы, такие как медь и железо, реагируют с азотной кислотой, образуя соответствующие соли и выделяя азотные оксиды. Это свойство активно используется при производстве пигментов, катализаторов и других химических веществ.
Вопрос-ответ

Какой эффект происходит при взаимодействии металлов с концентрированной азотной кислотой?
При взаимодействии металлов с концентрированной азотной кислотой происходит окисление металла и выделение оксидов азота, что может привести к образованию сильных взрывоопасных смесей.
Можно ли использовать азотную кислоту для очистки металлической поверхности?
Да, азотную кислоту можно использовать для очистки металлической поверхности от загрязнений и окислов. Она хорошо растворяет различные органические и неорганические соединения и эффективно удаляет ржавчину.
