Молекула металла представляет собой особую структуру, которая обладает своеобразными свойствами и внешним видом. В отличие от органических молекул, металлические молекулы обычно не имеют определенной геометрической формы и могут быть представлены различными кластерами или кластерами.
Структура металлических молекул может быть описана как группа атомов, связанных с помощью металлических связей. Эти связи представляют собой электронные облака, которые образуются за счет обмена свободных электронов между атомами металла. Благодаря этим связям металлические молекулы обладают высокой электропроводностью и теплопроводностью, а также характерным блеском и металлическим оттенком.
Внешний вид молекул металла зависит от их структуры и особенностей взаимодействия атомов. Например, металлические молекулы могут образовывать различные кристаллические структуры, такие как кубическая, гексагональная или пятиэдрическая. Каждая из этих структур имеет свои характерные особенности и влияет на физические свойства металла.
Более того, металлические молекулы могут иметь разные размеры и формы. Некоторые металлические молекулы могут быть крупными и сложными, в то время как другие могут быть маленькими и простыми. Эти различия в размерах и формах могут определять различные свойства металлов, такие как их плотность, тугоплавкость и твердость.
В целом, структура и внешний вид молекулы металла являются важными характеристиками, которые определяют физические и химические свойства металлов. Понимание этих особенностей позволяет ученым разрабатывать новые материалы с заданными свойствами и применять их в различных областях науки и техники.
Структура молекулы металла
Структура молекулы металла – одна из основных характеристик металлических соединений. Она определяет свойства металлов и их способность образовывать различные типы связей.
Молекула металла состоит из атомов металла, которые образуют кристаллическую решетку. Внутри решетки между атомами металла имеются свободные электроны, которые обеспечивают электропроводность и другие характерные свойства металлов.
Структура молекулы металла может быть различной в зависимости от типа металла и условий его получения. Например, некоторые металлы имеют кубическую кристаллическую решетку, такую как кристаллы железа или алюминия. Другие металлы имеют гексагональную решетку, например, магний или цирконий.
Определение структуры молекулы металла является важной задачей в научных исследованиях и промышленности. Изучение структуры позволяет предсказывать физические и химические свойства металла, а также разрабатывать новые материалы с заданными свойствами.
Металлическая кристаллическая решетка
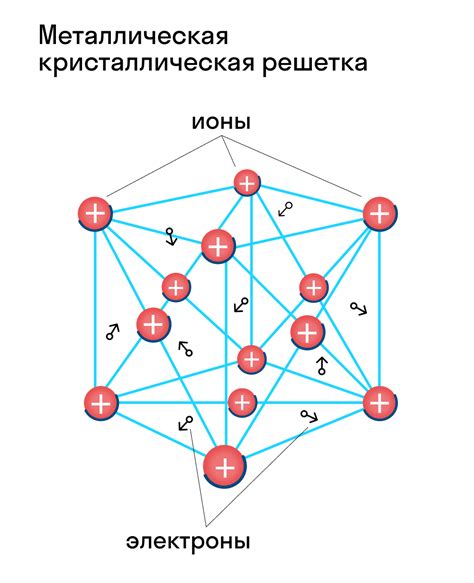
Металлы являются одним из основных классов веществ. Отличительной особенностью металлов является их способность образовывать кристаллическую решетку. Кристаллическая решетка металла формируется за счет упорядоченного расположения атомов внутри металлической структуры.
Внешний вид металлической кристаллической решетки подразумевает регулярное повторение элементарной ячейки, состоящей из атомов металла. Элементарная ячейка может быть различной формы, например, кубической, гексагональной или ромбической. В каждой элементарной ячейке атомы металла занимают точно определенные позиции, образуя равномерные ряды и слои.
Особенностью металлической кристаллической решетки является наличие свободных электронов, которые перемещаются между атомами металла. Эти свободные электроны обладают высокой подвижностью и отвечают за многие характеристики металлов, такие как электропроводность и теплопроводность.
Металлическая кристаллическая решетка обладает высокой прочностью и пластичностью. Это связано с особенностями структуры металла, где атомы имеют свободу перемещаться по кристаллической решетке без четко определенных позиций. Эта особенность позволяет металлам выдерживать внешние нагрузки и деформации без разрушения.
Связи между атомами металла
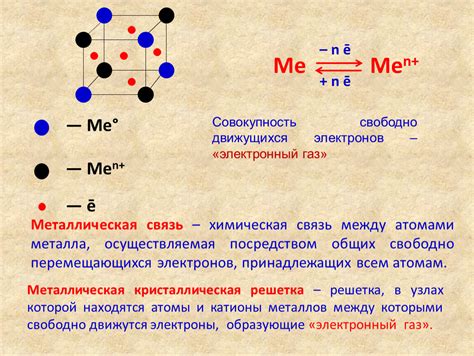
Металлы образуют специфические связи между своими атомами, которые определяют их химические и физические свойства. Одной из основных характеристик металлических связей является побочный характер молекулы металла, где атомы металла образуют регулярную кристаллическую решетку.
Металлическая связь представляет собой электростатическое взаимодействие между положительно заряженными ядрами атомов металла и свободными электронами, которые образуют "море" свободных электронов внутри кристаллической решетки. Эти свободные электроны являются общими для всех атомов металла и отвечают за характерные свойства металлов, такие как электропроводность, теплопроводность и отражательность света.
Металлические связи обладают высокой прочностью и эластичностью, что позволяет металлам сохранять свою форму и структуру при механическом напряжении. Кроме того, связи между атомами металла обладают высокой теплопроводностью, что позволяет металлам эффективно распространять тепло.
Также следует отметить, что связи между атомами металла обладают специфическими внешними свойствами, такими как блеск и отражательность света. Это связано с тем, что свободные электроны в металлической решетке способны поглощать и испускать световые волны, что придает металлам их характерный блеск и металлический оттенок.
Количество и распределение электронов
Структура и внешний вид молекулы металла в значительной степени определяются количеством и распределением электронов в его атомах. Электроны являются негативно заряженными элементарными частицами, которые образуют облако вокруг ядра атома.
Количество электронов в атоме определяется его атомным номером, который указывает на количество протонов в ядре атома и соответственно на равновесное количество электронов для обеспечения электрической нейтральности атома. В молекуле металла атомы могут соединяться друг с другом различными способами, образуя различные структуры.
Распределение электронов в молекуле металла может быть описано с помощью электронной конфигурации каждого атома, которая указывает на энергетические уровни, на которых находятся электроны. Атомы металла могут иметь несколько энергетических уровней, на которых располагаются электроны, и каждый уровень может вмещать определенное количество электронов.
Особенностью молекул металла является наличие общих электронных областей, которые могут быть образованы слиянием энергетических уровней нескольких атомов. Эти общие электронные области позволяют атомам металла обмениваться электронами и создавать устойчивые связи между собой.
Внешний вид молекулы металла
Молекулы металлов представляют собой особую структуру, которая отличается от молекул органических веществ. Они обладают высокой плотностью и металлическим блеском, что делает их отличительными от других типов молекул.
Молекулы металлов могут иметь различные формы и размеры. Они могут быть одномерными, двумерными или трехмерными структурами. В одномерных молекулах металлов атомы расположены в линию, в двумерных - в плоскости, а в трехмерных - в пространстве.
Во многих случаях молекулы металлов образуют кристаллическую решетку, которая состоит из упорядоченного повторения молекул. Это придает им особый внешний вид и делает их блестящими. Кристаллическая структура молекул металла может иметь различные формы, например, кубическую, гексагональную или тетрагональную.
Некоторые молекулы металлов могут образовывать сложные структуры, включая кластеры и полимеры. Кластеры состоят из нескольких атомов металла, связанных вместе посредством химических связей. Полимеры имеют длинные цепочки, состоящие из повторяющихся блоков. Эти сложные структуры придают молекулам металлов особенные свойства, такие как электропроводность и магнитные свойства.
Физические свойства молекулы металла
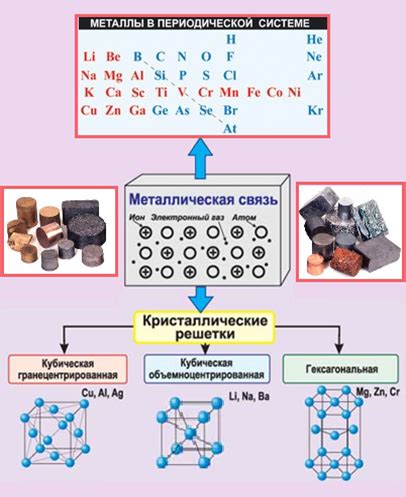
Металлическая связь. Молекулы металла обладают особым типом связи, который называется металлической связью. Основной особенностью этой связи является общая валентность электронов, которая позволяет молекулам металла образовывать кристаллическую решетку с высокой степенью упорядоченности.
Электрическая проводимость. Физическим свойством молекулы металла является ее способность проводить электрический ток. Это связано с наличием свободных электронов в металлической решетке, которые могут свободно перемещаться под воздействием внешнего электрического поля.
Теплопроводность. Металлы обладают высокой теплопроводностью благодаря свободному перемещению электронов. В результате этого процесса, тепловая энергия может передаваться быстро и эффективно через молекулы металла.
Объемная упругость. Молекулы металла обладают высокой степенью объемной упругости. Это позволяет металлам сохранять свою форму и структуру даже при значительных механических деформациях, таких как растяжение или сжатие.
Металлический блеск. Одно из характерных физических свойств молекулы металла - это ее характерный блеск. Это связано с особенностями отражения света металлом, который является хорошим отражателем световых волн.
Химические свойства молекулы металла

1. Электронные свойства:
Молекула металла обладает особыми электронными свойствами из-за наличия свободных электронов в своей структуре. Эти свободные электроны способствуют проводимости структуры металла и его электрическим свойствам. Также наличие свободных электронов делает молекулу металла хорошими агентами в реакциях окисления-восстановления.
2. Ионные свойства:
Молекула металла может образовывать ионы, потеряв или приобретя электроны. Это свойство проявляется в химических реакциях с другими веществами. Например, металлы могут образовывать положительные ионы (катионы), когда теряют один или несколько электронов.
3. Реактивность:
Металлы обладают разной степенью реактивности. Некоторые металлы, например, никель или платина, имеют низкую реактивность и не образуют легко стабильные соединения с другими элементами. В то время как другие металлы, такие как натрий или калий, реагируют с воздухом или водой достаточно активно, образуя окиси и гидроксиды.
4. Окислительные свойства:
Многие металлы проявляют окислительные свойства и могут окислять другие вещества в реакциях. Например, железо образует оксид железа (III) в реакциях с кислородом, окисляясь до более высокой степени окисления.
5. Способность к образованию соединений:
Молекулы металла могут образовывать различные соединения с другими элементами. В зависимости от своей электроотрицательности, металл может образовывать ионические соединения с неметаллами или металлические соединения с другими металлами.
Таким образом, химические свойства молекулы металла зависят от ее электронных свойств, ионной активности, реактивности, окислительных свойств и способности образовывать соединения с другими элементами.
Вопрос-ответ

Из чего состоит молекула металла?
Молекула металла состоит из атомов самого металла, объединенных между собой ковалентными или металлическими связями.
Каков внешний вид молекулы металла?
Внешний вид молекулы металла зависит от конкретного металла. Некоторые металлы могут образовывать кристаллическую решетку, а другие - аморфную структуру. Кристаллические молекулы металла могут иметь различные формы, такие как куб, октаэдр и другие геометрические формы.
