Щелочные металлы включают в себя элементы первой группы периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы обладают уникальными химическими свойствами, в том числе своей способностью образовывать ионы положительного заряда.
С ростом порядкового номера атомов щелочных металлов изменяется их способность принимать и отдавать электроны. Этот феномен объясняется изменением радиуса атома, а также его электронной структуры.
Радиус атомов щелочных металлов увеличивается с ростом порядкового номера. Это связано с тем, что с каждым новым элементом в периодической системе увеличивается количество электронных оболочек. Увеличение радиуса атомов приводит к увеличению их объема, что, в свою очередь, влияет на их способность взаимодействовать с другими атомами.
Кроме того, с ростом порядкового номера меняется электронная структура атомов щелочных металлов. У атомов лития, первого элемента в группе, только одна электронная оболочка. По мере увеличения порядкового номера, количество электронных оболочек увеличивается, что влияет на распределение электронов по энергетическим уровням и, следовательно, на способность атомов принимать и отдавать электроны.
Таким образом, с ростом порядкового номера атомов щелочных металлов изменяется их способность образовывать ионы, что является важным фактором для понимания их химических свойств и реакционной способности.
Способность атомов в щелочных металлах
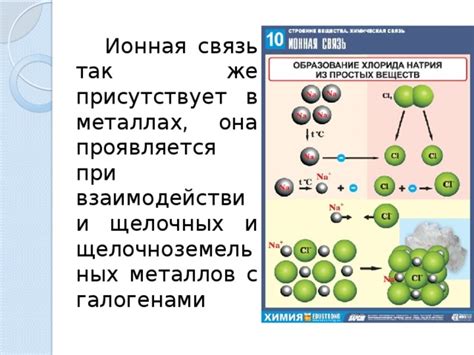
Способность атомов в щелочных металлах проявляется в их химических реакциях и физических свойствах. Щелочные металлы - это элементы первой группы периодической системы, к которым относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Атомы щелочных металлов обладают выраженной способностью к окислению и образованию ионов, поэтому они легко реагируют с водой, кислородом и многими другими элементами. Эта способность связана с тем, что внешний электронный слой у атомов щелочных металлов содержит всего один электрон. Вследствие этого, они стремятся отдать этот электрон и образовать ион с положительным зарядом.
Другим уникальным свойством атомов щелочных металлов является их низкая энергия ионизации. Это означает, что энергия, необходимая для удаления электрона из внешнего слоя, у них очень мала. Благодаря этому, щелочные металлы легко образуют положительные ионы, что позволяет им образовывать соли с отрицательно заряженными атомами.
Способность атомов к образованию ионов и реактивности щелочных металлов возрастает с ростом их порядкового номера. Например, литий имеет наибольшую способность к окислению, а франций - наименьшую. Это связано с тем, что с ростом порядкового номера увеличивается количество электронов в атоме, что делает его внешний электронный слой более защищенным и менее склонным к реакциям.
Влияние порядкового номера на способность атомов

Способность атомов щелочных металлов к изменению с ростом порядкового номера является важной характеристикой для понимания их химических свойств. Порядковый номер элемента определяет его положение в периодической таблице, и с каждым последующим элементом меняется электронная структура и химические свойства.
Взаимодействие атома с другими элементами происходит за счет электронного обмена. Количество валентных электронов, определяемое порядковым номером элемента, влияет на его способность образовывать химические связи. За счет своей низкой энергии и большого радиуса, атомы щелочных металлов (например, лития, натрия, калия) хорошо реагируют с другими элементами.
С ростом порядкового номера, увеличивается количество валентных электронов в атоме, что приводит к большей способности атома вступать в реакции. Натрий (11 валентных электронов) более реакционен, чем литий (3 валентных электрона), и имеет более широкий спектр возможных соединений.
Способность атомов щелочных металлов образовывать соединения также зависит от их ионизационной энергии. Чем меньше ионизационная энергия, тем больше атом готов отдать электрон и образовать положительный ион. Размер атома также влияет на его способность образовывать связи, так как больший атом имеет более слабое притяжение электрона к ядру.
В целом, с ростом порядкового номера атомы щелочных металлов становятся более реакционными и более склонными образовывать соединения с другими элементами. Изменение способности атомов с ростом порядкового номера является важным фактором при изучении химических свойств щелочных металлов.
Электроотрицательность и способность атомов щелочных металлов
Электроотрицательность представляет собой химическую величину, которая характеризует способность атомов притягивать к себе электроны в химической связи. У атомов щелочных металлов, таких как литий (Li), натрий (Na), калий (K) и другие, электроотрицательность относительно низкая.
Способность атомов щелочных металлов изменяется с ростом их порядкового номера в периодической системе. Например, литий имеет самую низкую электроотрицательность среди щелочных металлов, поэтому он проявляет высокую способность отдавать свои электроны другим атомам, образуя ион положительного заряда. В свою очередь, калий имеет более высокую электроотрицательность, и его способность отдавать электроны уже ниже.
Изменение способности атомов щелочных металлов с ростом порядкового номера связано с электронной структурой атома. По мере увеличения числа электронов и уровней энергии, атомы щелочных металлов становятся менее желающими отдавать свои электроны, так как электронные облака становятся более плотными и сильнее притягивают электроны к ядру. Это объясняет почему щелочные металлы находятся в самом начале периодической системы, наиболее склонные отдавать электроны в реакциях.
Способность атомов щелочных металлов отдавать электроны играет важную роль во множестве химических реакций, включая образование солей, а также в ионных сверхпроводниках и литиевых аккумуляторах. Это позволяет использовать щелочные металлы для различных приложений в электрохимии, металлургии и других отраслях промышленности.
Реакция атомов щелочных металлов с водой

Реакция атомов щелочных металлов с водой является ярким проявлением их химической активности. Щелочные металлы, такие как литий, натрий, калий и другие, обладают высокой реакционной способностью, что проявляется в том, что они способны быстро реагировать с водой.
В результате реакции атомов щелочных металлов с водой образуется щелочное гидроксидное соединение и высвобождается водород. Например, реакция между натрием и водой выглядит следующим образом:
- Атом натрия (Na) реагирует с молекулой воды (H2O).
- Натрий отдаёт один электрон молекуле воды, становясь положительно заряженным ионом Na+.
- При этом происходит разделение молекулы воды на ион гидроксида (OH-) и ион водорода (H+).
- Ионы натрия и гидроксида образуют щелочную соль — гидроксид натрия (NaOH).
- Высвобождающийся ион водорода скапливается, образуя пузырьки гидрогена.
Реакция атомов щелочных металлов с водой протекает очень быстро и сопровождается выделением тепла и образованием пузырьков. В зависимости от щелочного металла и его концентрации, реакция может быть более или менее интенсивной.
Такая химическая активность атомов щелочных металлов с водой объясняется их строением электронных оболочек. Атомы щелочных металлов имеют один валентный электрон на внешней энергетической оболочке, что делает их нестабильными и склонными к реакции с другими веществами.
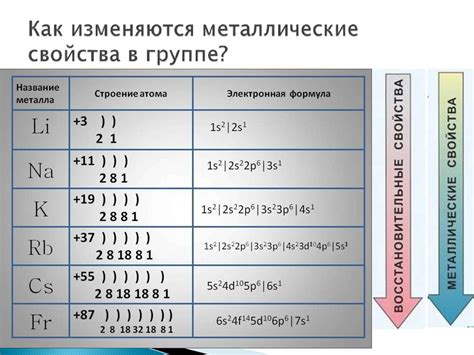
Изменение восстановительных свойств с ростом порядкового номера

Восстановление — это химическая реакция, при которой вещество получает электроны и повышает свою степень окисления. Щелочные металлы являются хорошими восстановителями благодаря своей высокой активности и первому энергетическому уровню, который они готовы отдать. С ростом порядкового номера восстановительные свойства щелочных металлов меняются и это связано с изменением их электронной структуры.
Главным образом, восстановительные свойства щелочных металлов усиливаются с ростом порядкового номера в периоде. Например, литий (Li), обладающий порядковым номером 3, имеет более низкую активность по сравнению с натрием (Na), порядковый номер которого равен 11. Калий (K) с порядковым номером 19 обладает еще большей активностью, а рубидий (Rb) и цезий (Cs) с порядковыми номерами 37 и 55, соответственно, являются самыми активными щелочными металлами. Это связано с тем, что с ростом порядкового номера увеличивается радиус атома щелочных металлов, что влияет на их электронную структуру.
Изменение радиуса атома влияет на энергетический уровень valence электрона и на качество его взаимодействия с другими электронами. С ростом порядкового номера, радиус атома щелочных металлов увеличивается, что увеличивает степень ионизации электрона и усиливает восстановительные свойства. Более крупные атомы легче отделяют электроны и более сильно восстанавливают другие элементы. Таким образом, щелочные металлы с большим порядковым номером имеют более высокую активность в химических реакциях восстановления.
Применение свойств атомов щелочных металлов

Атомы щелочных металлов, таких как литий, натрий, калий, рубидий и цезий, обладают рядом уникальных свойств, которые находят широкое применение в различных областях.
В первую очередь, свойства щелочных металлов позволяют использовать их в реакциях с водой или кислородом для производства водорода. Это особенно полезно в процессе получения водорода для использования в качестве легкого и экологически чистого топлива.
Щелочные металлы также широко используются в производстве стекла. Их ионы, добавленные в стеклянную массу, позволяют улучшить прозрачность и прочность материала. Кроме того, щелочные металлы позволяют изменять цветность стекла путем изменения пропорций в процессе производства.
В медицине щелочные металлы используются для различных целей. Например, литий применяется в лечении психических расстройств, таких как маниакально-депрессивное состояние и биполярное расстройство. Калий и натрий играют важную роль в регуляции работы сердечно-сосудистой системы и оказывают благоприятное влияние на работу мышц.
Некоторые щелочные металлы находят применение в сфере энергетики и технологий. Калий и натрий используются в производстве алкалиевых батарей и аккумуляторов. Широко применяются также натриевые лампы в освещении и солнечных батарейных установках. В некоторых видеоэкранах и телевизорах используется рубидий для улучшения качества изображения.
Вопрос-ответ

Как меняется способность атомов щелочных металлов с ростом порядкового номера?
С ростом порядкового номера в периоде щелочных металлов (например, от лития до франция) способность атомов к образованию ионов с положительным зарядом возрастает. Это связано с увеличением количества электронов в внешней энергетической оболочке атома. Чем больше электронов, тем больше вероятность того, что атом может потерять один или несколько электронов и образовать положительный ион. Таким образом, с ростом порядкового номера атомы щелочных металлов становятся более активными и реакционноспособными.
Почему с ростом порядкового номера способность атомов щелочных металлов к образованию ионов с положительным зарядом возрастает?
С ростом порядкового номера у щелочных металлов количество электронов в внешней энергетической оболочке увеличивается. Таким образом, с увеличением количества электронов в внешней оболочке возрастает вероятность потери одного или нескольких электронов атомом, образования положительного иона и его участия в химических реакциях. Поэтому с ростом порядкового номера щелочные металлы становятся более активными и реакционноспособными.
