Химическая связь – это взаимодействие атомов, ионов или молекул, обусловливающее их стабильное сосуществование в виде химических соединений. Для металлов характерны особые типы химической связи, такие как металлическая и ионная связи.
Металлическая связь возникает между атомами металла и проявляется в образовании кристаллической решетки, в которой положительные ионы металла находятся в окружении образовавшегося "облака" из свободных электронов. Эти свободные электроны обеспечивают проводимость электрического тока в металлах.
Ионная связь между металлами образуется при взаимодействии положительно заряженных ионов металла и отрицательно заряженных ионов, например, неметаллов. Такие химические соединения характеризуются высокой температурой плавления и хрупкостью.
Для составления схемы образования химической связи металлов необходимо учитывать особенности их электронной структуры, а именно количество электронов в последней оболочке атома. Схемы образования металлической или ионной связи помогут лучше понять принципы химического взаимодействия металлов и их участие в образовании соединений с другими веществами.
Например, для иллюстрации металлической связи можно использовать схему, на которой показано, как положительные ионы металла окружены облаком свободных электронов, обеспечивающих электропроводность. Для ионной связи между металлами и неметаллами можно представить схему, на которой изображены положительно заряженные ионы металла и отрицательно заряженные ионы неметалла, притягивающиеся друг к другу.
Основы образования химической связи

Химическая связь - это электростатическое притяжение между атомами, ионосферными или ковалентными соединениями, которое обеспечивает стабильность молекула и материала в целом.
В случае металлов, образование химической связи характеризуется их способностью отдавать электроны в связи с их низкой электроотрицательностью. Металлы образуют ковалентные связи с неметаллами или ионные связи с другими металлами. Этот процесс приводит к образованию кристаллических решеток, в которых атомы металла обладают свободными электронами.
Принцип образования химической связи для металлов определяется их электронной структурой. Внешний электронный уровень у металлов состоит из нескольких подуровней, каждый из которых может содержать определенное количество электронов. При образовании связи, металл отдает лишние электроны с внешнего уровня, чтобы стабилизировать свою электронную структуру. Это создает ионы, которые образуют ионные связи с другими металлами или образуют ковалентные связи с неметаллами.
Образование химической связи для металлов может также быть объяснено через формирование металлической связи. В этом случае, свободные электроны, которые металл отдает, образуют "облако" электронов, окружающее положительные ядра металлов. Это приводит к образованию металлической решетки, где положительные ядра и свободные электроны взаимодействуют друг с другом и создают связь.
Что такое химическая связь и зачем она нужна?
Химическая связь – это электростатическое взаимодействие между атомами, ионами или молекулами, которое обеспечивает их стабильность и формирование веществ. Она играет ключевую роль во многих химических процессах и является основой для образования различных химических соединений и материалов.
Химическая связь необходима для образования и стабилизации молекул, ионов и кристаллических решеток. Она позволяет атомам и молекулам объединяться, образуя новые соединения, которые обладают определенными физическими и химическими свойствами. Без химической связи не существовало бы химических соединений и материалов, которые мы используем в повседневной жизни.
Химическая связь определяет структуру и свойства веществ. Она может быть ковалентной, ионной или металлической, в зависимости от природы и величины взаимодействия атомов. Ковалентная связь обеспечивает силу межатомных связей в молекулах, ионная связь важна для образования солей и других ионных соединений, а металлическая связь характерна для металлов и обеспечивает их особенные свойства.
Химическая связь также играет важную роль в химической реакции. В процессе химической реакции происходит прерывание, перераспределение и образование новых химических связей, что позволяет превращать одни вещества в другие и осуществлять различные химические превращения. Благодаря химической связи мы можем синтезировать новые вещества, создавать новые материалы и использовать их в различных областях науки и технологий.
Основные типы химической связи
Химическая связь – это электростатическое взаимодействие между атомами, ионосферами или молекулами, которое обусловливает их взаимное привлечение и формирование химических соединений. Существуют несколько основных типов химической связи, включая ионную связь, ковалентную связь и металлическую связь.
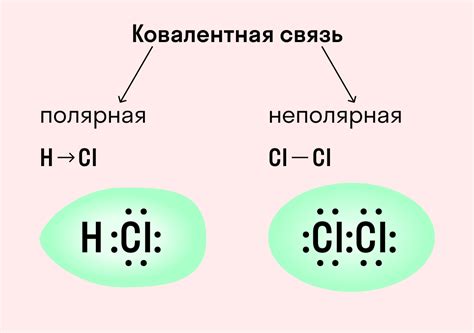
Ионная связь возникает между атомами с различной электроотрицательностью, когда один атом отдает электрон(ы) другому, образуя ион положительного ион отрицательного заряда. При таком взаимодействии образуются ионы, которые притягиваются друг к другу электростатическими силами.
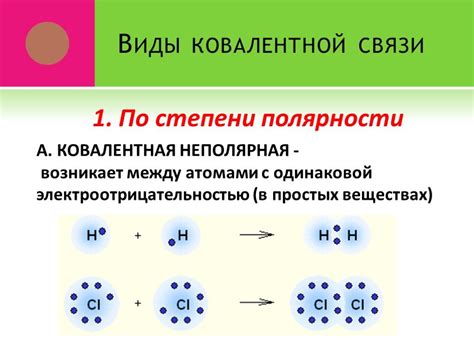
Ковалентная связь формируется между атомами с похожей электроотрицательностью, при которой электроны общих пар электронов находятся между двумя атомами. При такой связи электроны образуются общие электронные пары, что обеспечивает стабильность атомов и структуру молекулы.
Металлическая связь возникает между атомами металлов, где электроны свободно движутся по всей структуре металла. Такая связь обеспечивает характерные свойства металлов, такие как проводимость тепла и электричества, пластичность и ковкость.
Химическая связь в металлах

Химическая связь в металлах является одним из основных факторов, определяющих их особые физические и химические свойства. Металлы обладают отличными проводимостью электрического тока и теплоты, высокой пластичностью и механической прочностью. Эти свойства объясняются особенностями химической связи между атомами металлов.
Химическая связь в металлах осуществляется путем обмена свободными электронами между атомами. В металлической решетке атомы металла образуют плотно упакованные положительно заряженные ядра и свободные электроны, которые движутся свободно между ядрами. Такая свободная межатомная структура является основой для объяснения проводимости и деформируемости металлов.
Химическая связь в металлах характеризуется ионно-электронной теорией связи. Согласно этой теории, атомы металла отдают свои внешние электроны общей оболочке свободных электронов, образуя ионы положительного заряда. Свободные электроны образуют "облако" около ионных ядер и создают силу притяжения, которая удерживает ионы на своих местах в решетке металла.
Эта особенность химической связи в металлах позволяет им образовывать сплавы, т.е. смеси двух или более металлов. В сплавах с различными металлами электроны смешиваются и образуют новую решетку, что приводит к изменению химических и физических свойств материала. Сплавы широко используются в промышленности и производстве изделий, так как позволяют достичь определенных свойств, которые недоступны для чистых металлов.
Как образуются химические связи в металлах?

Химические связи в металлах образуются благодаря особому строению и свойствам металлической структуры. Основной тип химической связи, присутствующий в металлах, называется металлической связью.
Металлическая связь возникает из-за особенностей электронной структуры металлов. Атомы металла имеют малое количество валентных электронов, что позволяет им образовывать множество связей с другими атомами. Эти связи образуют трехмерную решетку, в которой положения атомов металла занимают кристаллические узлы.
Главным источником электронов для металлической связи служат свободные электроны, находящиеся в плотной "море" электронов. Именно эти свободные электроны не привязаны к конкретным атомам и обеспечивают поддержание связи между атомами металла.
Такая свободная подвижная электронная система делает металлы электропроводными и хорошими проводниками тепла. Также она отвечает за способность металлов формировать высокопроводящие и гибкие структуры.
В целом, металлическая связь обладает высокой прочностью и позволяет металлам образовывать сплошные и твердые материалы. Именно благодаря этим свойствам металлы находят широкое применение в различных областях, начиная от строительства и машиностроения, до электроники и промышленности.
Особенности химической связи в металлах

Химическая связь в металлах отличается от связи в молекулярных соединениях, таких как соли или органические вещества. Основным отличием является наличие электронов проводимости в металлах, которые формируют так называемую металлическую связь или свободную электронную пару.
Металлическая связь образуется благодаря особенностям электронной структуры металлических элементов. Внешние электроны у металлов обладают низкой энергией и слабой привязанностью к атомным ядрам. Поэтому они легко могут передвигаться по металлической решетке и образовывать "облако" свободно движущихся электронов.
Эти свободные электроны являются основой для образования электронных облаков, которые существуют внутри металлической решетки. Благодаря этому металлы обладают высокой электропроводностью и теплопроводностью.
Металлическая связь обеспечивает химическую устойчивость металла и его способность к деформации и пластичности. Свободные электроны могут передвигаться вдоль решетки, что позволяет металлам легко принимать форму и выдерживать давление, что особенно важно в случае использования их в строительстве или машиностроении.
В целом, уникальные свойства химической связи в металлах обеспечивают им широкое применение в различных отраслях промышленности и повседневной жизни.
Вопрос-ответ

Какие методы использовать для составления схем образования химической связи у металлов?
Для составления схем образования химической связи у металлов можно использовать различные методы, такие как модель свободных электронов, метод октета, ковалентный метод и метод перекрестных связей.
Что такое модель свободных электронов и как она помогает в составлении схем образования химической связи у металлов?
Модель свободных электронов представляет металл в виде решетки положительно заряженных металлических ионов, окруженных облаком свободных электронов. Эти свободные электроны играют роль общих электронов и создают между атомами металла металлическую связь.
Какой метод использовать для составления схем образования химической связи у металлов, если они не образуют ионных соединений?
Если металлы не образуют ионные соединения, можно использовать ковалентный метод. В этом случае, атомы металлов могут образовывать ковалентные связи с другими атомами металлов, оставаясь нейтральными или образуя положительно и отрицательно заряженные комплексы.
Какие особенности присутствуют в схемах образования химической связи у металлов?
В схемах образования химической связи у металлов присутствуют особенности, такие как образование металлической связи, возможность образования положительно и отрицательно заряженных ионов, возможность образования ковалентных связей и участие свободных электронов.
